--0.jpg) Fig.1
Fig.1
GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Reacciones de
precipitación 13
Precipitación del Co(II) (Primera parte)
Primeramente sobre una disolución saturada de nitrato de cobalto(II) (fig.1), echamos unas gotas hidróxido cálcico, formándose un precipitados rosa (fig.2 y 3).
--0.jpg) Fig.1
Fig.1
-2.jpg)
Fig3(detalle)
Si ahora agregamos
unas gotas de disolución de carbonato sódico, se produce un precipitado
violeta, con mayor densidad que se dispone en el fondo del tubo de ensayo (fig 4,5 y 6)

Fig.9 (detalle)
-3.jpg)
Fig.4

Fig.8
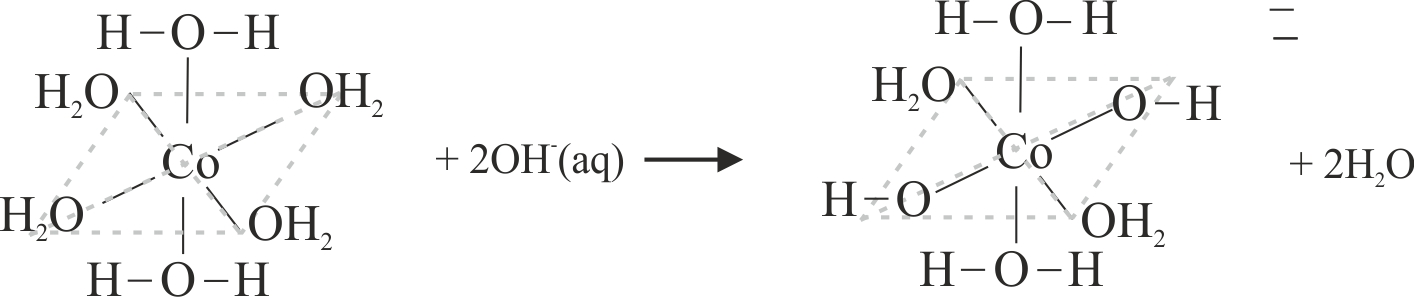
-3A.jpg) Fig 5(ampliación)
Fig 5(ampliación)
Tal como cuando le echamos sólo a la disolución de nitrato de cobalto, gotas de carbonato sódico (fig 10,11 y 12).
Las reacción química que se produce es:
Co(NO3)2(ac)+2Na2CO3 (ac) ![]() CoCO3(s)++2NaNO3(ac)
CoCO3(s)++2NaNO3(ac)
Observación:
Los cambios de colores en los complejos del Co(II), están estudiados en
la sección Química a la gota, complejos del Cobalto (I), de esta web.
-4A.jpg) Fig6 (detalle)
Fig6 (detalle)
 Fig.11
Fig.11

Fig.7
-4b.jpg)
Fig.12
Si embargo si sobre la disolución saturada de nitrato de cobalto(II), echamos
unas gotas de Na(OH), se produce un precipitado que se va tornando violáceo
(fig.7,8y 9)
Los colores rosáceos que va tomando el precipitado, se deben al intercambio de ligandos agua por (OH)-.

Fig.10
-2b.jpg)
Fig.2
ALMACÉN
Determinación de la masa molar del oxígeno
Aproximación al Número de Avogadro
Determinación del número de moléculas de agua de cristalización de una sal
Cinética de la reacción del ión tiosulfato en medio ácido
Punto de congelación de una mezcla de naftaleno y paradiclorobenceno
Calor de neutralización de un ácido fuerte con una base fuerte
Cinética de la reacción entre los iones peroxodisulfato y los iones yoduro
Estequiometría de la reacción entre el ácido clorhídrico y el mármol
Estequiometría de la reacción entre el yoduro potásico y el nitrato de plomo(II)
Cinética química de la reacción entre los iones yodato e hidrógenosulfito
Iniciación a las masas relativas y al mol
Redox con tartrato, agua oxigenada y sulfato de cobre(II)
Reacción entre el cloruro de estaño(II) y el cloruro de mercurio(II)
Reacción del sodio con el agua
Electrólisis del cloruro de estaño(II)
Cristales de sulfato de cobre(II)
Introducción a los potenciales redox
Reacción entre el permanganato potásico y glicerina
Reacciones de precipitación de sales de plata(I)
Reacciones de precipitación de sales de plata(II)
Reacciones de precipitación de sales de plata(III)
Reacciones de precipitación de sales de plata(IV)
Reacciones de precipitación de sales de Hg(II) y Cu(II), I
Reacciones de precipitación de sales de Hg(II) y Cu(II), II
Reacciones de precipitación del Fe(III), I
Reacciones de precipitación del Fe(III), II
Reacciones de precipitación del Fe(II)
Reacciones de precipitación del Ni(II)