
Fotografía 1
GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA

Fotografía 1
CINÉTICA DE
Objetivo
Medir experimentalmente el tiempo que tarda una reacción química en alcanzar una determinada concentración y a partir de las medidas deducir cómo varía ese tiempo en función de la concentración inicial de tiosulfato.
Material
Buretas (3)
Vaso de precipitados de 100mL
Vaso de precipitado de 250 mL
Erlenmeyer de boca ancha
Cronómetros (uno por alumno). Sirven perfectamente los cronómetros que llevan incorporados muchos relojes de pulsera.
Papel transparente con una cruz marcada
Retroproyector.Embudos (3) (opcionales)
Productos químicos
Disolución de tiosulfato de sodio, Na2S2O3
Disolución de HCl
Este experimento se propone como
expe-riencia de cátedra, con participación activa de todos los alumnos del grupo.
Antes de comenzar el experimento el profesor tendrá dispuesto en la mesa de trabajo, tres buretas etiquetadas con los productos químicos que contienen y tres botellas etiquetadas con esos productos El erlenmeyer lo dispondrá vacío encima del retroproyector y de la cruz, así los alumnos verán el dispositivo tal como se muestra en la fotografía 1
A continuación debe explicar cómo van a trabajar coordinadamente el profesor y los alumnos.
Lo que a continuación se explica debe hacerse como prueba de ensayo para que los alumnos sepan cómo tienen que operar.
En el erlenmeyer se añadirá un volumen de agua y a continuación un volumen de tiosulfato y en el vaso de 100 mL se mide el volumen de ácido.
En este momento se explica la
reacción química qué ocurrirá cuando los reactivos se mezclen en le erlenmeyer
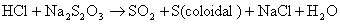
O en forma iónica según el criterio del profesor y los conocimientos de los alumnos
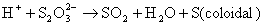
Después de la explicación teórica se procede a hacer la demostración de entre-namiento.
El profesor toma el vaso de 100
mL que contiene el ácido y vierte su contenido rápidamente en el erlen-meyer
al mismo tiempo que los alumnos ponen en funcionamiento sus cronómetros (fotografía
2)

Fotografía 4
Una vez realizada la prueba de ensayo el profesor reparte la hoja de trabajo a cada alumno. Damos un posible modelo:
Modelo
Nombre y apellidos ……………………………… Curso ……….. Número de lista………
Toma de datos
| Volumen de agua H2O/mL |
Volumen de Na2S2O30,3
M en mL |
Volumen de HCl en mL |
Tiempo medido por el alumno t/s |
| |
|
|
|
| |
|
|
|
| |
|
|
|
| |
|
|
|
| |
|
|
|
| |
|
|
|
Cálculos
|
Inverso del tiempo de cada alumno
|
Tiempo promedio del conjunto de la clase tm/s |
Inverso del tiempo promedio
|
Concentración
inicial de la disolución de tiosulfato , |
| |
|
|
|
| |
|
|
|
| |
|
|
|
| |
|
|
|
| |
|
|
|
| |
|
|
|
a) Con los datos de su tiempo construya las gráfica 1) concentración
de tiosulfato (eje Y) frente a tiempo propio del alumno (eje X) 2) Concentración
del tiosulfato (eje Y) frente al inverso del tiempo medido pro el alumno (
eje X). Calcule la pendiente de la recta
b) Con los tiempos promedio de la case y la concentración de tiosulfato haga las mismas representaciones que en el apartado a)
Calcule la diferencia en % entre la pendiente obtenida con sus datos y con los datos del promedio de la clase.
Procedimiento experimental
1) Llene y enrase cada una de
las buretas (este trabajo puede hacerlo el profesor o un alumno bajo la vigilancia
del profesor)
2) Vierta en el erlenmeyer el
volumen de agua y a continuación el volumen de tiosulfato
3) Lleve el erlenmeyer encima
del papel transparente que lleva dibujada la cruz y que está colocado sobre
el retroproyector, el cual, por ahora, se mantiene apagado, para evitar el
calentamiento del reactivo.
Los alumnos han debido anotar todos los volúmenes medidos en su hoja de
trabajo
4) Mida en el vaso de 100 mL el
volumen de HCl y acérquese al erlenmeyer. Ahora prevenga a los alumnos que
va a verter el contenido del vaso en el erlenmeyer y que mediante una orden
por medio de la voz les dirá cuando
lo hace, para que ellos pongan en marcha el cronómetro. Encienda el retroproyector
y vierta el contenido del ácido mientras los alumnos toman el tiempo que tarda
la cruz en desaparecer de su vista.
5) Una vez medidos los tiempos
por todos los alumnos se procede a apagar el retroproyector y a lavar y enjuagar
el erlenmeyer y el vaso de 100 mL, En este tiempo los alumnos deben rellenar
la casilla de inverso de tiempo propio.
6) El proceso se repite hasta
completar las medidas.
7) Recoja todos los tiempos de
los alumnos y proceda a calcular el valor medio de cada tiempo, desechando
los valores que por su discrepancia con la media así lo aconseje.
8) Comunique a los alumnos los tiempos medios y deje para su casa o incluso en el laboratorio si así lo estima, la construcción de las gráficas y el cálculo del % de desviación

Fotografía 3
Les dice y así la verán, que la
cruz cada vez aparece más oscura como consecuencia de la formación del azufre
coloidal (fotografía 3)
A continuación se les dice que
cada alumno detendrá su cronómetro cuando estime que ha dejado de ver la cruz
en la pantalla (fotografía 4)

Fotografía 2