
Fig.1
GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Pilas
electroquímicas con objetos I
Hemos
estudiado las pilas elecroquímicas con los pares metálicos Cu y Zn (PQ-27)
y Cu y Sn (PQ-28) y Sn frente al Zn. Ahora vamos a comparar
el electrodo de Cu, frente al Ag, en formato de moneda
Para ello se realizará el montaje que se observa en la fig1. Un vaso de precipitados pequeño (100mL), con una disolución de sulfato de cobre (II) aproximadamente 1M, en el que se sumerge una lámina de cobre, y otro vaso de precipitados similar en el que se dispone una disolución de nitrato de plata también 1M, unidos ampos por un puente de papel de filtro. Si la barra de cobre la conectamos al polo positivo del voltímetro por el cable rojo tal como hacíamos antes y la moneda de plata (de 100pts) al polo negativo por el cable azul, indicaría una ddp negativa (fig.1). Al conectarlos correcta-mente, esto es la plata con mayor potencial de reducción, al polo positivo el voltímetro ya señala la diferencia de potencial, correcta (fig.2). El detalle se aprecia en la fig.3 y la pila formada se esquematiza en la fig 4 (siempre que haya pasado cierto tiempo).

Fig.1

Fig.2

Fig.3
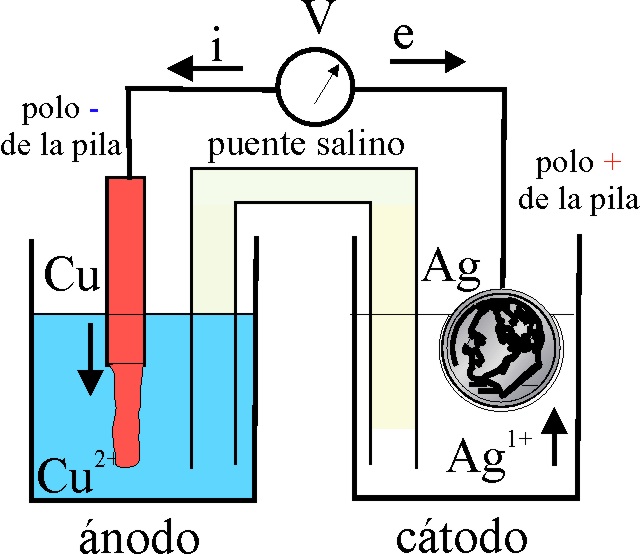
Fig.4
Se deberá tener en cuenta que la disolución
salina, no puede ser ni un cloruro, ni emplear agua con iones cloro, debido
que a que precipita el cloruro de plata muy insoluble. La explicación de la
fig 4, se basa en que el potencial
de reducción de Ag+/Ag es superior al del Cu2+
(fig.5) y por lo tanto los electrones
circulan de la barra de Cu a la moneda
de plata, por lo que la barra de cobre irá disolviéndose, aumentando la concentración
de Cu2+ (se volverá mas azulada), mientras que 2 moles de Ag1+,
al tomar 2 moles de electrones depositarán 2 moles de Ag metálica en la parte de la moneda sumergida.
Teóricamente la diferencia de potencial
de la pila formada debería ser de 0,80-0,34V=0,46V, en condiciones estándar,
que no se dan en este caso, marcando 0,42-0,43V.

Fig.5
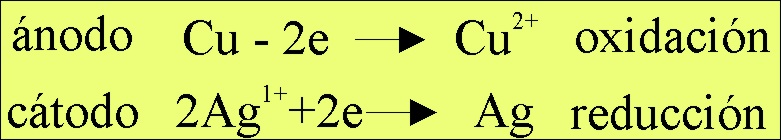
Fig.6

Fig.7
Si
sustituimos la lámina de Cu, por una moneda de cobre, o de aleación Cu/Sn
(bronce), la pila formada se haría con dos monedas, obteniendo los resultados,
que se observan en las figuras 8 y 9

Fig.8

Fig.9 (detalle)
El proceso redox que tendría
lugar sería (fig.6)
La simbología de la pila electroquímica formada será la dada en la fig 7