Una vez que los alumnos tienen esa gráfica se
les da una regla muy sencilla ¨Un metal
es capaz de reducir al que tiene por encima de él ¨. De modo general cuanto
más separada esté la raya de un metal de la del hidrógeno más probable y rápida
será la reacción que dé lugar a la producción de hidrógeno gaseoso.
Así, según esa tabla, el más reductor es el
magnesio y el menos reductor el mercurio De acuerdo con esa tabla son posibles
las reacciones
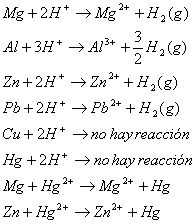
Como fuente de los iones H+ utilizamos
HCl de concentración entre 1 y
Experimentalmente se trata de comprobar si esas
predicciones son ciertas. Para ello empleamos el retroproyector con lo que
logramos gastar muy poco producto y además los hechos pueden observarlos un
grupo numeroso de alumnos.
Material
Vaso de precipitados
Pinzas
Mg
Al,
Zn
Pb
Cu
Cloruro de mercurio (II)
Cápsulas Petri
Retroproyector

Foto 1
En la fotografía
1 se observan los metales empleados y por su tamaño se deduce que se necesitan
cantidades muy pequeña,s por lo que la práctica es muy económica.
Procedimiento
1) El Profesor coloca una cápsula Petri sobre
el retroproyector y añade en ella la
disolución de ácido clorhídrico. A continuación explica que allí están presentes
los iones H+.
2) Toma un trocito de cinta de magnesio y la
coloca sobre el ácido de la capsula(foto2)
Inmediatamente comienza una reacción muy rápida por lo que muy pronto
el magnesio desaparece (foto 3). Los alumnos observan en pantalla la formación
de burbujas que aparecen de color negro.

Foto 2
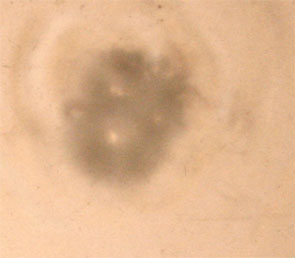
Foto 3

Foto 4
En la reacción empleamos un poquito de cinta de magnesio la
cual doblamos sobre sí misma para que su superficie fuese mínima, aún así,
la reacción es tan rápida que la cámara
no puede captar la formación de burbujas
3) El Profesor coloca otra cápsula Petrí con
ácido y añade el cinc. Los alumnos observan que al principio hay un periodo
en que apenas se observan burbujas, pero pasado este tiempo, pueden observarse
con claridad. No hay duda que esta reacción transcurre más lentamente que
con el magnesio

Foto 5
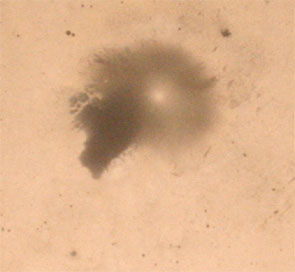
Foto 6(detalle)
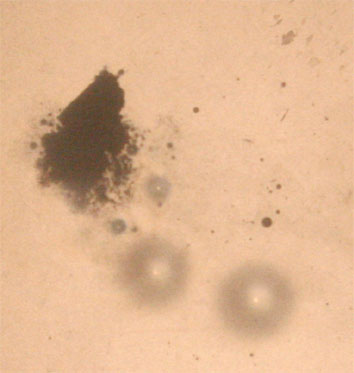
Foto 7(detalle)

Foto 8(detalle)

Foto 9(detalle)

El cinc reacciona
con el ácido y provoca la formación de burbujas, unas parecen como negras
si son de pequeño tamaño, pero si se forma alguna burbuja grande aparece en
pantalla como una mancha oscura con un punto brillante en el centro. Al final
aparecen motitas negras que son burbujas pequeñísimas de gas que no han estallado.
4) El Profesor prepara otra cápsula con ácido
y anuncia que va a añadir aluminio. Los alumnos esperan que la reacción transcurra
con una rapidez intermedia entre la
del magnesio y la del cinc. Cuando el profesor añade el aluminio aparentemente
no sucede nada. Es el momento de explicar que este metal forma una capa de
óxido impermeable que impide el contacto entre el aluminio y el ácido (esta
es la razón de que las ventanas fabricadas con aluminio se utilicen en la
construcción, pues su corrosión es casi nula , mientras que las de hierro
necesitan recubrirse de pintura). Tal capa se elimina en parte, raspando con
una lima la pieza de aluminio. Luego
se añade una pieza limada al ácido. La reacción comienza
y aun cuando al principio es muy lenta a medida que transcurre el tiempo se
hace tan rápida o más que la del cinc. (Fotos 11-15)

Foto 11

Foto 12

Foto 13
Foto 14

Foto 15
El aluminio tarda
en incidir la reacción como puede observarse por el reloj, pero una vez iniciada
transcurre con rapidez.
5) El
Profesor prepara otra cápsula con ácido y anuncia que va a añadir plomo. No
se observa reacción ni aun limando la pieza. La posible explicación (incompleta)
es que el metal tiene su “línea” tan cerca de la del hidrógeno que de haber
reacción es tan lenta que no se percibe. Se recuerda a los alumnos que el
plomo se ha empleado durante muchos
años en las conducciones de agua y
los recipientes de este metal prácticamente no son atacados por el ácido sulfúrico.

Foto 16

Foto 17
En las fotografías
el plomo ha estado en contacto con el ácido aproximadamente una hora sin que
se observase cambio alguno

Foto 18

Foto 19
7) El Profesor toma una
muestra del metal cinc y la divide en dos partes. Añade una de ellas a una
disolución de cloruro de mercurio y espera un tiempo. Luego toma las dos piezas
y de forma simultánea las añade al ácido que está en la cápsula. La no tratada
reacciona y la que ha estado en contacto con el cloruro de mercurio no. La
explicación es que la pieza de cinc se ha recubierto de mercurio (forma una
amalgama) y según la tabla el mercurio no
reacciona con el ácido.
Una variante de esta presentación es hacer reaccionar
un trozo de cinc con ácido , luego
retirarlo de la cápsula, sumergirlo en la disolución de cloruro de
mercurio y volverlo a añadir al ácido El cinc que se retira después de la
reacción con el ácido es casi negro pero al amalgamarlo se vuelve brillante.
El cinc amalgamado
con mercurio no reacciona con el ácido
8) Se repite el proceso anterior con el magnesio.
GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
INTRODUCCIÓN A LOS POTENCIALES
REDOX
Introducción
En los libros de Química aparecen las tablas
de potenciales de reducción de los elementos y de los compuestos. En este
artículo solamente, y en forma gráfica, representamos los correspondientes
a unos metales de uso corriente en los Centros.