GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
CALOR DE NEUTRALIZACIÓN
DE UN ÁCIDO FUERTE Y UNA BASE FUERTE
INTRODUCCIÓN
En este experimento se prescinde
del cálculo del equivalente en agua del calorímetro ya que la experiencia
nos dice que es un valor difícil de determinar y con resultados a veces
dispares. Esto conlleva que los resultados experimentales que se obtienen
pueden diferir de los de la bibliografía entre un 5% y un 10%. La ventaja
principal es que el experimento de realiza
en muy poco tiempo y además se utiliza como calorímetro un par
de vasos de plástico de distinto tamaño. El hueco
entra ambos vasos se rellena con papel. Finalmente otra ventaja es que se utilizan termómetros graduados de
grado en grado, que son de los que normalmente se dispone en los laboratorios
OBJETIVO
Determinar experimentalmente el calor que se engendra
al reaccionar un ácido fuerte con una base fuerte
MATERIAL
Agitador (varilla de vidrio)
Calorímetro (dos vasos de plástico de diferente tamaño. El hueco entre
ambos se rellena con papel)
Termómetro(1)
Probeta (2)
Pinza de bureta y
soporte (opcional)
Vaso de precipitado
(2) (para manejar con comodidad los reactivos)
Productos
Disoluciones 5M de
HCl y NaOH
Las disoluciones debe prepararlas el Profesor. Los alumnos deben utilizar gafas de seguridad

Material necesario y reactivos
PROCEDIMIENTO
1. Se miden con la probeta 50 mL de la disolución de HCl y se colocan en el calorímetro. Se miden 50 mL de la base los cuales se vierten en un vaso de precipitados (fig.1) y de éste y de forma muy rápida se añaden sobre el ácido ( fig.2). Se debe advertir a los alumnos que cuando echen la base sobre el ácido retiren la cara para evitar que les alcance alguna salpicadura.

fig 1

fig 2
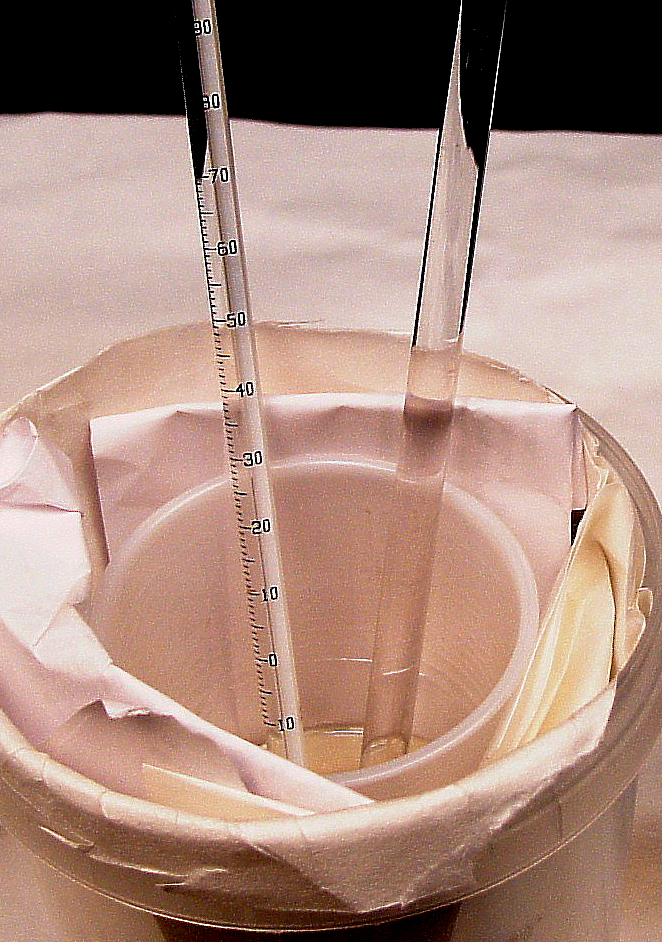
fig 3

fig.4
2. La operación se repite 3 veces, cambiando los volúmenes
de ácido y de base, a 40 mL y a 60 mL.
3. Se realizan los
cálculos, suponiendo que el calor específico de la mezcla que reacciona
es igual a la del agua: 4,18 J/(ºC g). Las densidades
de las disoluciones consultadas en las tablas, son respec-tivamente HCl
5M: 1,08 g/mL, y NaOH 5M: 1,18g/mL.
Una variante de estos
cálculos, válida para alumnos aventajados, puede verse en el apéndice.
4. Compare los valores obtenidos, con el dado por las
tablas, 56,8 kJ/mol y calcule el
error cometido.
OBSERVACIONES
Los datos que se dan
a continuación proceden de un experimento real y pueden servir para entrenar
a los alumnos.
Temperatura inicial
del ácido y de la base 17ºC- Temperatura
final
Densidad de la disolución
de HCl 5 M tomado de las tablas 1,08 g/mL
Densidad de la disolución
de NaOH
Masa de la mezcla
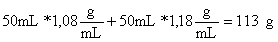
Calor generado en
la mezcla y absorbido por ésta
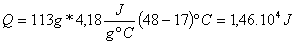
Dado que en la reacción
han intervenido solamente
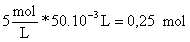 ;
;
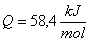
APÉNDICE
La reacción química es:
![]() . Teniendo en cuenta que es muy rápida cuando se mide la temperatura máxima en realidad
se mide la de una disolución de cloruro de sodio en agua. La bibliografía
proporciona datos del calor específico de las mezclas de cloruro de sodio
y agua
. Teniendo en cuenta que es muy rápida cuando se mide la temperatura máxima en realidad
se mide la de una disolución de cloruro de sodio en agua. La bibliografía
proporciona datos del calor específico de las mezclas de cloruro de sodio
y agua
| N moléculas de H2O/ 1”molécula” de
NaCl |
Calor específico c/ Jg-1ºC-1 |
| 10 |
3,25 |
| 20 |
3,61 |
| 50 |
3,89 |
| 100 |
4,18 |
Cálculos
Moles
de cloruro de sodio formados en la reacción= moles de ácido o de base
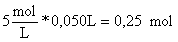
Moles
de agua después de la reacción
Moles de agua en el ácido+moles de
agua en la base+moles de agua formados
Moles
de agua en el ácido =
![]()

Moles
de agua en la base =
![]()
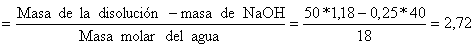
Moles
de agua después de la reacción = 2,49+2,72+0,25 = 5,46 mol
Moles
de cloruro de sodio formados en la reacción 0,25
Relación =
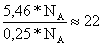
El
calor específico de la mezcla se obtiene interpolando en la tabla de valores
3,62 J/(g ºC). De acuerdo con los valores anteriores
resulta
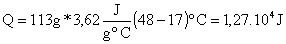
Calor
de reacción
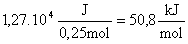
DH =
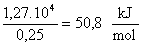
Como se observa la hipótesis de suponer que el calor
específico de la muestra es igual a la del agua no es correcto. Este resultado
nos indica que para mejorarlo hemos de considerar el equivalente en agua
del calorímetro.
Cabe destacar que
este resultado aun cuando dé un error mayor que el obtenido anteriormente,
resulta más lógico que el anterior ya que al existir pérdidas de energía
calorífica lo lógico es encontrar un valor inferior al de la bibliografía,
mientras que en el caso anterior es superior, lo cual resulta contradictorio.