
Fig.1
GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
La pila Daniell en el aula de Química
En 1839 en su libro titulado “Introduction to Chemical Philosophy”, publica el inglés Daniell la primera pila electroquímica, que todavía se estudia en las clases de Química, en las Enseñanzas Medias, cuya foto y esquema se adjunta (fig.1 y 2).
Se basaba en las tendencias de
dos metales, cobre y cinc, puestos en contacto entre si y con las disoluciones
de sus sales forma de sulfatos. Naturalmente vamos a reproducir un montaje
en la actualidad. Para eso contamos con dos vasos de precipitados, dos chapas
de cobre (rojizo) y de cinc (grisáceo), y en cada vaso o hemicelda, disponemos
de disoluciones 1M de sulfato de cobre (II) (azul) y sulfato de cinc (II)
(transparente), todo ello unido a través de un voltímetro didáctico, para
que el alumno pueda ver la diferencia de potencial establecida (fig.3 y 4)

Fig.1
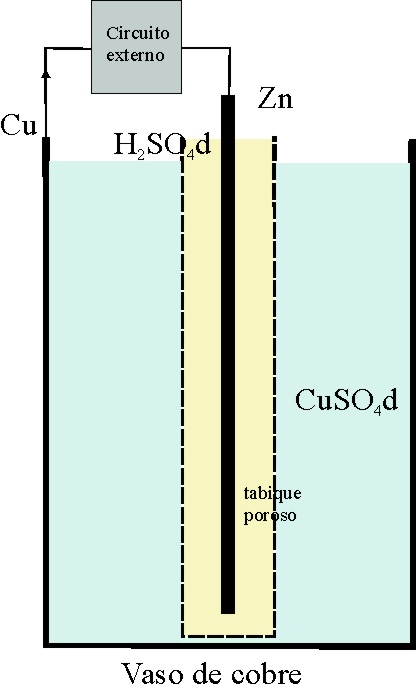
Fig.2
Naturalmente el sistema no funciona dado que el circuito está abierto, hay que unir los dos recipientes con el llamado “puente salino”, que no es mas que un papel de filtro doblado y humedecido con una disolución salina (fig.5 y 6 (esquema).

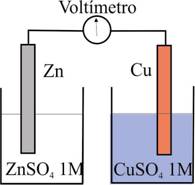
Fig.4 (Esquema)

Fig.5 (detalle del puente salino)
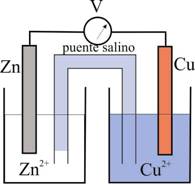
Fig.6 (Esquema)
Al principio
el voltímetro que tarda en estabilizarse marca 1,03V, pero
al cabo de cierto tiempo ya indica 1,08V (1,1V en condiciones estándar) (fig.7)
Si la conexión con pinzas de cocodrilo, desde la barrita de Cu, no se hace al polo positivo del voltímetro, el voltímetro no marca o lo que indica tiene el signo negativo como vemos (fig.8).Quiere decir que el sentido de la corriente que circula va desde la barra de cobre a la barra de cinc, y por lo tanto el cobre será el polo positivo de la pila.

Fig.7
En consecuencia los electrones circularán en sentido contrario e irán del Zn al Cu. Por lo tanto:
El Cu2+ de la disolución, tomará dos electrones para
depositarse como Cu sobre la lámina de cobre, con lo cual la concentración
de la disolución disminuirá, haciéndose
el color azul que depende del complejo que forma el Cu2+, se hará
menos intenso, mientras que el cinc de la lámina oxidándose al perder 2 electrones,
pasará a Zn2+.
La hemicelda donde ocurre la oxidación recibe el nombre de ánodo, mientras que aquella donde se produce la reducción es el cátodo [1] , y se puede recordar por las reglas vocal y consonante, dado que el lugar y el proceso comienzas con ese tipo de letras.

Fig.8
La doble barra
pretende simbolizar el puente salino

Fig.10 ( dato a las 24 horas)

Fig.11( Dato a las 96 horas)
Este
hecho lo explicó Nernst, al formular las ecuaciones que regulaban la variación
de los potenciales de reducción con la concentración de los reaccionantes.
En el proceso de la pila Daniell Cu2++Zn →
Cu + Zn2+,
∆E=∆Eº- (0,06/n) log Q.
Q es el cociente
de la reacción y n el número de electrones que se transfieren por mol de Zn que se disuelve, o por mol de Cu2+
que se deposita, en este caso 2.
Teniendo
en cuenta que las concentraciones de los sólidos se consideran la unidad,
para cada elemento de la pila Daniell, en su hemicelda
sería:

Fig.13

Fig.14
[1] Estos nombres de origen griego los puso Faraday por indicación de su amigo y escritor Whewell, en función de los fenómenos electromagnéticos que estaban de moda en ese época, al margen de las transferencias electrónicas, dado que esta partícula se nombraría y descubriría 60 años después.
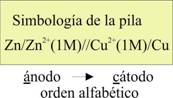
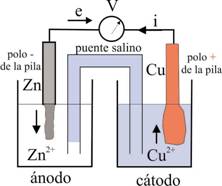
Fig.9
E oxidante = E0-(0,06/n)
log (1/[Cu2+])=0,34+0,03log[Cu2+];
E reductor= E0-(0,06/n)
log ([Zn2+] =-0,76-0,03log[Zn2+].
Conforme pasa el tiempo la concentración del oxidante es <1M, y 0,03log[Cu2+]<0, con lo que el potencial de reducción disminuye, mientras que el del reductor aumenta, como se observa (fig.12).
Cuando
se igualan, se alcanza el equilibrio, Q=K, y el voltímetro marcará 0.
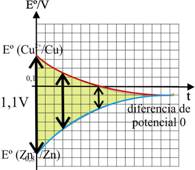
Fig.12