
Fotografía 1
GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
ELECTRÓLISIS DEL CLORURO DE ESTAÑO(II)
Introducción
En esta web, en la sección de Química a la gota y en el apartado electrolisis salinas V (ubicada
en el almacén) se ha expuesto, mediante fotografía digital, la electrolisis
del cloruro de estaño(II) con electrodos metálicos.
Ahora realizamos la misma electrolisis utilizando
específicamente electrodos de hilo de estaño y realizándola en el retroproyector,
lo que permite su observación a un numeroso grupo de alumnos
Material
Erlenmeyer de 250 mL Embudo de vidrio Papel de filtro
Cápsula Petri
Cuentagotas Retroproyector
Hilo de estaño de soldar Pila de 4,5 V Cables de cobre (2)
Pinzas de cocodrilo (4) SnCl2.4H2O HCl concentrado
Preparación
del material
Previamente a la presentación del experimento
el Profesor prepara una disolución
de cloruro de estaño(II), disolviendo
Con hilo de estaño se construyen
dos electrodos de forma circular pero sin cerrarlos,
los cuales se colocan en la cápsula Petri tal como se ve en la fotografía 1. Para evitar
que éstos se muevan durante el experimento, se fijarán con celo a la parte
metálica del retroproyector, no sobre la lente, ya que el pegamento podría
crear una mancha sobre ésta.
Finalmente dispone la pila como indica la fotografía 1 pero con uno de los cables todavía sin unir a la pila.

Fotografía 1
El cátodo es el electrodo
de menor tamaño. Se observa que forma un puente por encima del ánodo. Ambos
electrodos rebasan el tamaño de la lente del retroproyector y están fijos
mediante celo a la parte metálica del retroproyector. El cátodo se une al polo negativo de la pila y el ánodo al positivo.
Procedimiento
1) El Profesor muestra a los alumnos el dispositivo
y proyecta la imagen en la pantalla. Luego añade la disolución de cloruro
de estaño, cierra el circuito eléctrico y realiza la electrolisis durante
unos quince minutos.
En las fotografías se observa el desarrollo
del proceso. Al comienzo de la electrolisis (fotografías 2, 3, y 4) se ve que en el cátodo se desprende burbujas
que en pantalla son bolitas negras que estallan

Fotografía 2

Fotografía 3

Fotografía 4
Algo más tarde se observa que el desprendimiento de gas disminuye
y el cátodo aumenta de tamaño, más tarde el desprendimiento gaseoso cesa y
el cátodo sigue aumentando de tamaño, pero
llega un momento en que aparecen unos cristales filiformes que van llenado
el espacio entre los electrodos (fotografías 5,6,7 y 8). En el ánodo
parece que no ocurre nada, tal vez un pequeño adelgazamiento del mismo pero
que es muy difícil de observar. El Profesor debe hacer estos comentarios para
mantener la atención de los alumnos.

Fotografía 5

Fotografía 6
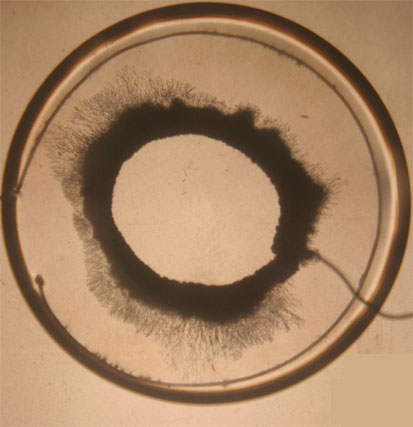
Fotografía 7
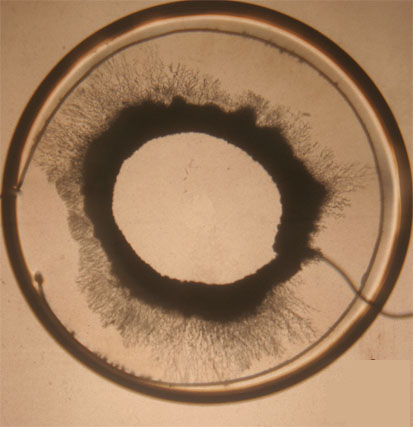
Fotografía 8
En estas fotografías
puede observarse lo que se ve en pantalla a medida que transcurre el tiempo.
Finalmente se forman unos hilos filiformes de estaño que llegan a tocar
el ánodo.
Nosotros no hemos
detectado que en ese momento se produzca un cortocircuito en la pila, pero
el Profesor debe estar atento por si eso ocurriese lo que daría lugar a un
calentamiento violento de la pila
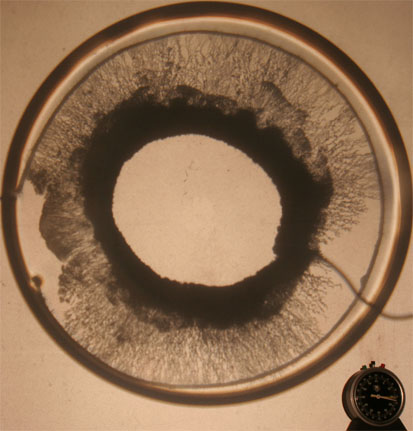
Fotografía 9

Detalle del reloj de la fotografía 9
2) Finalizada la electrolisis los alumnos deben
observar cómo ha cambiado el cátodo de tamaño con un depósito brillante rodeándolo.
Se extrae el ánodo y se observa que en la parte que no ha estado dentro de
la disolución tiene brillo metálico pero la parte sumergida aparece mate
y recubierta de una sustancia de aspecto oscuro.
Al final de la electrolisis y al agrupar el estaño formado sobre el cátodo, puede verse que éste aparece recubierto de diminutos cristalitos del metal (fotografía 10)

Fotografía 10
3) Una vez que los alumnos han observado el
fenómeno el Profesor debe dar una interpretación de los hechos. Primero debe
explicar los iones que existen en la disolución
Cationes: Sn2+,
H+ ; Aniones: Cl-, OH- , también indicará
que existen gran número de moléculas H2O, la conexión
de los bornes de la pila a los electrodos y la emigración de los iones
al los electrodos.
En el cátodo se pueden producir las siguientes
reacciones
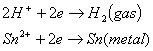
En el ánodo pueden ocurrir los siguientes procesos
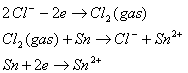
Nota
para el profesor.
Las reacciones que ocurren en los procesos electroquímicos
dependen de muchos factores: naturaleza de los electrodos, tensión de la corriente,
grado de pureza del electrolito, etc. Por tanto se debe ser cauto al explicar
las reacciones siempre haciendo ver
al alumno que es una interpretación de los hechos pero que las reacciones
pueden ser mucho más complicadas que las explicitadas anteriormente.