GRUPO
HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA
DE LA FÍSICA Y LA QUÍMICA
sección:
PRÁCTICAS DE QUÍMICA
REACCIÓN DEL SODIO CON AGUA
Objetivo
Mostrar alguna propiedad del metal sodio y dos modos de presentación
de la reacción de este metal con agua.
Material
Vaso de precipitados de 250 mL
Fenolftaleína
Sodio
Retroproyector
Detergente
Agitador
Cápsula Petri
Tijeras , o navaja.
Procedimiento
1) El Profesor muestra a los alumnos el recipiente
que contiene el metal sodio y les destaca que el elemento hay que protegerlo
del contacto con el aire debido a su gran reactividad, por ello, se guarda
bajo petróleo.
2) Toma una barra de sodio y la corta, indicando
así que se trata de un metal blando. Muestra que en el corte reciente aparece
un brillo que es característico de los metales. Poco tiempo después el brillo
desaparece, debido a la oxidación del metal por el oxígeno del aire.
3) El Profesor añade en el vaso de precipitados, agua, un poquito
de detergente y unas gotas del indicador fenolftaleína. La disolución es incolora.
Vierte esta disolución en la cápsula Petri
y la coloca sobre el retroproyector. En la pantalla aparece una imagen grande
de ella. Toma un trocito pequeño de sodio
y lo añade a la cápsula. Los alumnos verán en la pantalla
que el trocito de sodio tiene forma esférica y se mueve por la superficie del líquido (el
sodio es un metal de los clasificados como ligeros, esto quiere decir que
su densidad es inferior a la del agua y entre otras razones al añadirlo
al cápsula de Petri flota sobre la
disolución acuosa) ,chocando y rebotando en las paredes, al mismo tiempo la
disolución se colorea de rosa, lo que indica que en la reacción entre el sodio
y el agua se forma una sustancia básica. El fenómeno dura unos segundos. También
puede aparecer alguna mancha oscura que es debido a pequeñas burbujas de hidrógeno.
Ahora el profesor escribe la reacción entre
el sodio y el agua.
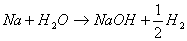
Dado que el fenómeno es vistoso y atrae la atención
de los alumnos es recomendable repetir el proceso.
En las fotografías 1, 2, 3, 4, 5 y 6,
aparecen imágenes del proceso, tomadas con cantidades variables de fenolftaleína
y en distintos momentos del proceso.
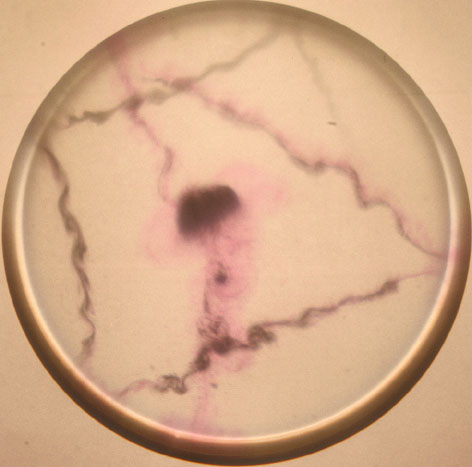
Foto 1
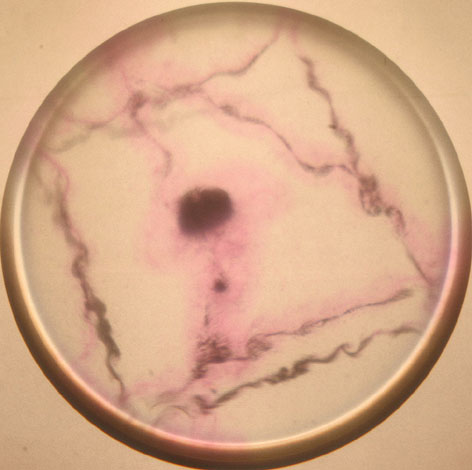
Foto 2
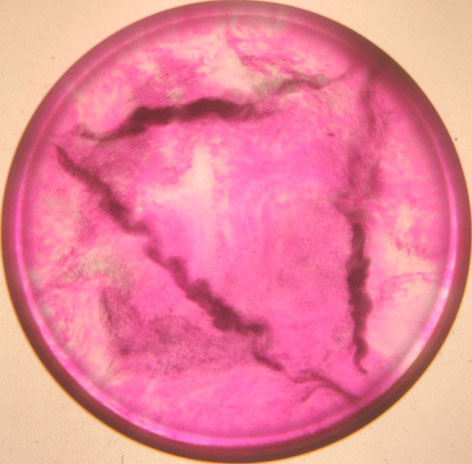
Foto 3

Foto 4
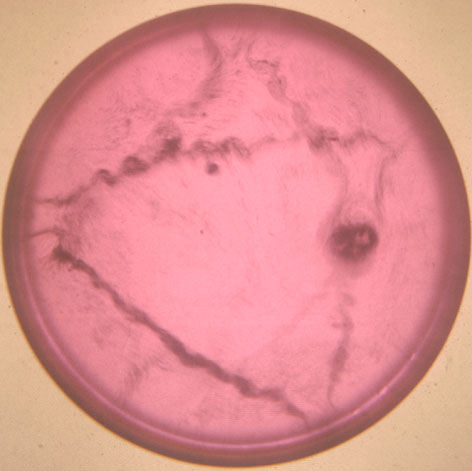
Foto 5
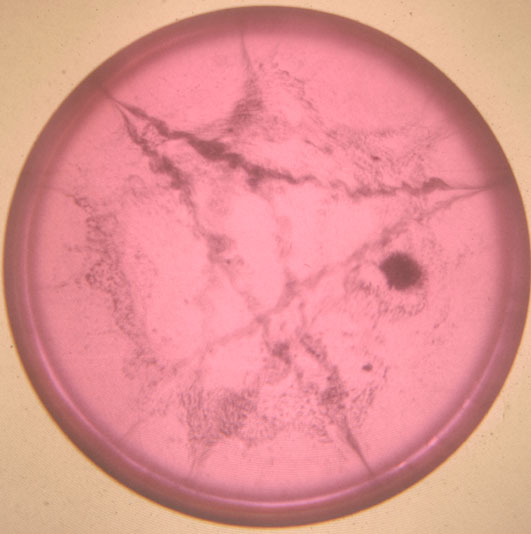
Foto 6
Trayectorias realizadas
por el sodio sobre la superficie acuosa. La cantidad de fenolftaleína varía
de unas fotos a otras. El proceso, una vez añadido el sodio hasta que desparece,
dura varios segundos.

Foto 8

Foto 9(detalle)
4) El Profesor dispone un vaso de 250 mL con
agua hasta la mitad. Toma un trocito de sodio y lo envuelve en papel de filtro
dejándolo fuertemente aprisionado, lo echa sobre
el agua, se retira a una distancia de varios metros y espera unos segundos.
El agua penetra por los poros del papel de filtro y reacciona con el sodio; transcurridos unos
segundos el metal se inflama de forma
violenta dando lugar a una llamarada espectacular de color amarillo acompañada de un chasquido. Algunos trozos de
sodio vuelan por el aire. Este fenómeno puede observarse en las fotografías
7, 8 y 9.

Foto 7
Estas fotografías
se realizaron en la oscuridad, sin embargo la llamarada es tan brillante que
cuando se realiza el experimento ante los alumnos no es necesario oscurecer
el recinto.
Este proceso es una consecuencia de que la reacción
del sodio con el agua es fuertemente exotérmica y que el sodio es fácilmente
inflamable dando vapores de color amarillo.
Notas
para el Profesor
La reacción del sodio con el agua es tan violenta
que el profesor debe ser consciente de que debe tomar precauciones cuando la realice
ante sus alumnos.
Las cantidades de sodio deben ser muy pequeñas.
Por ejemplo, en la experiencia en la cápsula de Petri, el tamaño de la esfera
de sodio es inferior al milímetro. Conviene que el profesor realice
algún ensayo previo antes de mostrar el experimento a los alumnos. Si el tamaño
del sodio es demasiado pequeño, éste al añadirlo a la cápsula Petri puede adherirse a la pared y no desplazarse por el
líquido, si es demasiado grande puede inflamarse dar una llamarada y esparcirse
dañando la lente o el espejo del retroproyector.
En el experimento 4) de inflamación del metal,
el tamaño es un poco mayor que en el de la cápsula Petri, pero también es
conveniente que el profesor haga algún ensayo previo, para que la reacción
sea espectacular pero no demasiado violenta, ya que si esto ocurre pueden
proyectarse trozos de sodio ardiendo incluso a distancias grandes.
En cuanto a la posición de los alumnos, éstos
deben estar siempre a varios metros de distancia tanto en el experimento 3)
como en el 4) , e incluso es aconsejable que lleven gafas de seguridad.
Si el
Centro dispone de potasio, este metal reacciona tan violentamente con el agua,
que en nuestra opinión, no debe realizarse su reacción con el agua.








