GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
PUNTO DE CONGELACIÓN
DE MEZCLAS DE NAFTALENO Y p-DICLOROBENCENO
OBJETIVO
Comprobar los puntos de fusión de sustancias puras y
mezclas
Calcular
las cantidades de disolvente y soluto
para tener concentraciones determinadas
Determinar aproximadamente el valor de la constante crioscópica del naftaleno cuando actúa como disolvente
MATERIAL
Balanza
Espátula
Tubo
de ensayo de boca ancha -Termómetro
Mechero
(puede servir el mechero de alcohol)- Mortero- Cronómetro
Soportes,
nueces y pinzas de bureta
PRODUCTOS QUÍMICOS
Naftaleno- Para-diclorobenceno
Para esta práctica puede utilizarse con buenos
resultados el p-diclorobenceno que se vende en las droguerías para combatir
la polilla. Generalmente es de una pureza de casi el 100%. El naftaleno
también puede encontrarse en algunas tiendas, de todas formas es un producto
barato.
PROCEDIMIENTO
1) Antes de proceder
a determinar puntos de congelación de mezclas es recomendable hacer la
gráfica temperatura tiempo de cada uno de los dos productos y así poder
tener los puntos de fusión de los productos empleados. El procedimiento
consiste en fundir el producto puro, introducir el termómetro en el interior de la sustancia líquida y tomar
las temperaturas en función del tiempo. Con los datos se construye la
gráfica temperatura ( eje Y) frente a
tiempo ( eje X).La
temperatura correspondiente a la parte horizontal de la curva es
el punto de fusión
2) Los productos químicos
deben estar molidos a grano muy fino. Sobre la base de pesar
3) Se calienta suavemente
la mezcla hasta que esté completamente
líquida y luego se introduce el termómetro en el seno de la disolución.
El bulbo del termómetro debe quedar en el centro de la masa y no tocar
las paredes del tubo (ver foto 1)
Si al introducir el
termómetro se forma sólido es preciso volver a calentar con cuidado hasta
la fusión completa (foto 2)
Se retira la calefacción
y se toman las temperaturas de
minuto en minuto, poniendo especial atención en observar la aparición
de sólido en la disolución. Con los datos se construye una gráfica y se
deduce el punto de fusión de la mezcla.
FOTOGRAFÍA DEL MONTAJE


foto 1
4) Si la experiencia
la han hecho un grupo de alumnos con distintas molalidades se reúnen todos
los datos y se construye una gráfica de la molalidad ( eje X) frente al descenso
crioscópico (eje Y) De la gráfica se deduce el valor aproximado de la
constante.
Se puede comprobar
la calidad del trabajo de cada grupo teniendo en cuenta su desviación
respecto de la constante crioscópica del naftaleno que en la bibliografía
es 6,8-
NOTAS
Los alumnos deben utilizar gafas de seguridad.
Si la habilidad experimental del alumno no es buena, entonces no debe
utilizar el calentamiento directo con el mechero para fundir las mezclas,
sino utilizar un baño de agua contenida
en un vaso de precipitados en el
que se introduce el tubo de ensayo. El calentamiento del agua se hace
utilizando mechero y rejilla.
La limpieza de los tubos de ensayo requiere
cuidados. Una vez realizado el experimento con un determinado tubo se
vuelve a fundir el producto y se extrae el termómetro. Después si aparece
sólido se vuelve a calentar para fundirlo y una vez fundido se vierte
rápidamente el contenido sobre un papel
de periódico. Si se opera con rapidez se consigue eliminar la mayor parte
del contenido del tubo. El que queda por las paredes se consigue eliminar
frotando con la escobilla. A veces si se calienta en exceso puede inflamarse
el producto en la boca del tubo, si ocurre cúbralo con un trapo. Esta operación de limpieza no la deben realizar
los alumnos.

foto 2
OBSERVACIONES
Los resultados experimentales
obtenidos han sido los siguientes
| molalidad |
0,00 |
0,57 |
0,94 |
1,07 |
1,17 |
1,90 |
2,53 |
| Temperatura de congelación/ºC |
80 |
75,5 |
72,5 |
73,3 |
70,0 |
67,0 |
62,3 |
| )T/ºC |
0 |
4,5 |
7,5 |
6,7 |
10,0 |
13,0 |
17,7 |
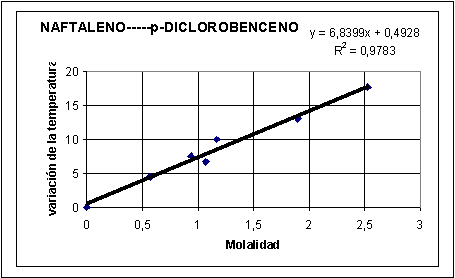
La pendiente dará de forma aproximada la constante
crioscópica del naftaleno
Kc = 6,84 K. kg/mol
Kc naftaleno según bibliografía: 6,89 K kg/mol