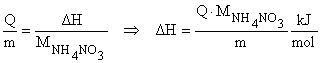Fotografía 1
GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Proceso endotérmico
Fundamento
Cuando un soluto, sólido, líquido o gaseoso, se disuelve en un disolvente
líquido, pueden ocurrir dos casos:
a) Que la mezcla de ambos adquiera una temperatura mayor que la inicial, proceso
que se denomina exotérmico. b) Que la mezcla disminuya de temperatura, proceso que se denomina endotérmico.
Un proceso endotérmico, fácil y barato de realizar, es utilizar como soluto
el nitrato de amonio y como disolvente el agua. El planteamiento del experimento
puede hacerse de dos formas. Una, la más sencilla, es utilizar una cantidad de soluto del orden de los
La otra forma consiste en realizar el mismo experimento acompañado de
cálculos sencillos que permitan determinar, aproximadamente, la variación
de entalpía del proceso endotérmico
y comparar los valores obtenidos con los que proporciona la bibliografía.
Este segundo método es el que exponemos.
Material
Calorímetro
Termómetro
Nitrato de amonio, NH4 NO3
Balanza
Probeta de 250 mL
Dispositivo para colocar el termómetro (base , varilla y pinza).
Agitador magnético
Cristalizador
Vasos de precipitados (3)
Puede usarse como calorímetro uno de plástico de los que suele haber en
los centros escolares, o fabricarse uno con dos vasos de precipitados, uno
de 1000 mL, (vaso exterior), y otro
de 400 mL, (vaso interior) , aislados entre sí mediante papel. (ver las fotografías).
El soluto nitrato de amonio suele formar terrones por lo que debe molerse
lo más finamente posible.
Si no se dispone de agitador magnético, puede utilizarse una varilla de
vidrio como agitador manual.
Si se desea recuperar el nitrato de amonio, las disoluciones de cada una
de las medidas se añaden en el cristalizador y se deja evaporar el agua.
Procedimiento
1) Haga el montaje de la fotografía 1.
Añada en el vaso interior del calorímetro 250 mL de agua.
Pese
Ponga en marcha el agitador de forma suave
Anote la temperatura indicada por el termómetro.
En el que nosotros utilizamos, si el nivel del líquido termométrico queda
entre dos divisiones, adjudicamos la temperatura a la división que esté más
cercana al nivel del líquido termométrico. Por ejemplo si el nivel está entre
las divisiones 20 y 21 y más cerca
de 21, anotamos

Fotografía 1

Ampliación de la indicación del termómetro de la foto 1
2) Vierta el nitrato de amonio sobre el agua, observe cómo disminuye la
temperatura y anote el valor más pequeño indicado por el termómetro (se alcanza
ese mínimo en menos de dos minutos
de agitación).

Fotografía 2

Ampliación de la indicación del termómetro de la foto 2

Fotografía 3

Ampliación de la indica-ción del termómetro de la foto 3

Fotografía 4

Ampliación de la indicación del termómetro de la foto 4
4) Haga otras medidas, siguiendo el procedimiento indicado con 75, y

Fotografía 5


Fotografía 6

Ampliación de la indicación del termómetro de la foto 6

Fotografía 7

Ampliación de la indicación del termómetro de la foto 7

Fotografía 8

Ampliación de la indicación del termómetro de la foto 8
Cálculos
Calcule la disminución de la energía calorífica de la disolución mediante
la expresión:
![]()
Siendo M la masa del agua y del soluto, expresada en kg.
Como calor específico de la disolución tomamos el del agua
![]()
La variación de temperatura Dt es la diferencia
entre la temperatura inicial y la final.
Q es la energía calorífica en kJ por m gramos de nitrato de amonio, por
lo que