ESTEQUIOMETRÍA DE
Objetivo
Comprobar experimentalmente cuántos moles de
HCl reaccionan con un mol de carbonato de calcio.
Material
Bureta
Vaso de precipitados de 250 mL ( 5)
Erlenmeyer (2)
Cinco trozos de mármol
Mechero
Rejilla
Acceso a una balanza que aprecie como mínimo
centésimas de gramo
Indicador rojo de metilo
Bórax de alta pureza
Disolución de ácido clorhídrico
Procedimiento
1) Se pesan y anotan las masas de los cinco
trozos de mármol
2) Cada trozo se coloca en un vaso de precipitados
de 250 mL y se añade un volumen de ácido distinto en cada vaso y se deja que
la reacción transcurra en frio.
3) Mientras se verifica la reacción anterior,
se valora el ácido clorhídrico. Para ello se pesa una determinada cantidad
de bórax, el cual se pone en un erlenmeyer.
Se añade agua destilada y se calienta suavemente hasta que el bórax se disuelva.
Luego se añade el indicador rojo de metilo y sobre la anterior disolución
se añade el ácido hasta que se produzca el cambio de color.
La valoración debe hacerse como mínimo dos veces
con resultados concordantes.
4) Cada uno de los vasos que contiene el mármol
que ha reaccionado con el ácido, se
calienta suavemente, con la finalidad de asegurarse que la reacción se ha completado.
5) Se añade agua a cada uno de los vasos, se
extraen los trozos de mármol que no
han reaccionado , se secan ,
entre papeles de filtro, y se pesan.
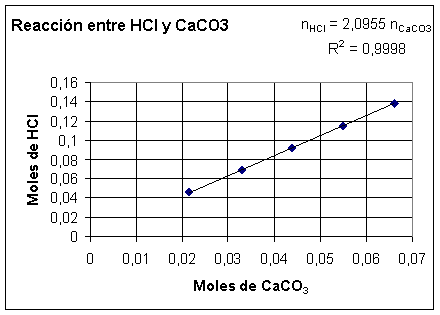
6) Posteriormente, se calcula los moles de ácido
clorhídrico que han reaccionado y los de carbonato de calcio. Se representan gráficamente estos valores y la
medida de la pendiente de la recta nos da el valor experimental de los moles
de ácido que reaccionan con un mol de carbonato de calcio.
Notas para el Profesor
Este experimento debe realizarse solamente
con alumnos que tengan experiencia en el trabajo
de laboratorio. Naturalmente deben trabajar con gafas de seguridad.
Si la sesión de trabajo es de tres horas cada
alumno realizará cinco medidas y además valorara el ácido empleado, se seguirá
el procedimiento antes indicado
Si el tiempo es alrededor de una hora, cada
alumno o grupo de dos alumnos, realizará una sola medida y no valorará el
ácido, sino que se le dará su normalidad como dato. Por tanto el Profesor
debe previamente valorar el ácido. Para obtener buenos resultados es imprescindible
que la normalidad del ácido esté bien determinada. Se puede emplear como patrón
primario un borax de muy buena calidad. La reacción entre el ácido y el borax
es:
![]()
Si no se dispone de borax puede valorarse con
carbonato de sodio anhidro. El carbonato comercial de buena calidad anhidro
debe calentarse en estufa a unos
Las disoluciones de ácido deben ser algo concentradas,
no menor es que
En la reacción propuesta el carbonato de calcio
es el reactivo en exceso, por consiguiente, el profesor debe advertir a los
alumnos sobre los pesos aproximados de los trozos de mármol en función del
volumen de ácido que añadan, para que siempre el reactivo limitante sea el
ácido clorhídrico.
Solución
Datos procedentes de un alumno
| Masa inicial del trozo de mármol, mi /g |
Volumen de HCl añadido V/mL |
Masa final del trozo de mármol, mf/g |
Gramos de carbonato de calcio que han reaccionado |
Moles de carbonato de calcio que han reaccionado |
| 4,00
|
10,0
|
1,85
|
2,15
|
0,0215
|
| 6,05
|
15,0
|
2,75
|
3,30
|
0,0330
|
| 8,03
|
20,0
|
3,65
|
4,38
|
0,0438
|
| 10,08
|
25,0
|
4,60
|
5,48
|
0,0548
|
| 12,15
|
30,0
|
5,54
|
6,61
|
0,0661
|
La valoración del ácido se hizo con bórax y
los resultados fueron
y
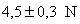
Los resultados finales
| Moles de carbonato de calcio que han reaccionado |
Volumen de HCl añadido V/mL |
Moles de HCl que han reaccionado |
Moles de HCl / 1 mol de carbonato de calcio |
| 0,0215
|
10,0
|
0,046
|
2,1
|
| 0,0330
|
15,0
|
0,069
|
2,1
|
| 0,0438
|
20,0
|
0,092
|
2,1
|
| 0,0548
|
25,0
|
0,115
|
2,1
|
| 0,0661
|
30,0
|
0,138
|
2,1
|