GRUPO
HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA
DE LA FÍSICA Y LA QUÍMICA
sección:
PRÁCTICAS DE QUÍMICA
Reacción
entre los iones permanganato y oxalato
Fundamento
El ión permanganato
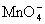 reacciona con el ión oxalato
reacciona con el ión oxalato
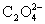 en medio ácido sulfúrico
según la reacción global
en medio ácido sulfúrico
según la reacción global
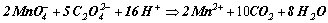
La reacción es claramente visible, puesto que la disolución de permanganato
es violeta y el ión Mn2+
en disolución diluida es incoloro. Así al mezclar los reactivos se observa
el color violeta y con el transcurso del tiempo el color se va desvaneciendo
hasta que la mezcla de reacción aparece incolora.
Una característica de esta reacción es que se cataliza mediante el ión
Mn2+, que es a su vez un producto de la reacción por lo
que al proceso se titula como autocatalítico.
Esta práctica la presentamos como demostración de cátedra, aunque puede
realizarse para grupos de dos alumnos.
Material
Agitador magnético
Probeta de 100 mL(3)
Vaso de precipitados
Cronómetro
Disolución de permanganato de potasio KMnO4 , 0,29 g/L
Disolución de oxalato de sodio Na2C2O4,
8 g/L
Acido sulfúrico concentrado H2SO4
Sulfato de manganeso
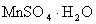
Las concentraciones de los reactivos se puede variar en función del tiempo
que se desee para el transcurso de la reacción (la reacción puede hacerse
durar más de diez minutos), aunque
siempre el oxalato debe estar en exceso.
Procedimiento
1)
Presente los reactivos como se indica en la fotografía 1

Fotografía 1
La probeta 1 contiene
12 mL de sulfúrico concentrado; la 2, 100 mL de la disolución de permanganato
y la 3, 100 mL de la disolución de
oxalato de sodio
2) Vierta el permanganato en el vaso de reacción, ponga en marcha el agitador de forma lenta, y a continuación añada el ácido sulfúrico, esto
provoca una subida de la temperatura, por lo que la reacción transcurrirá
en un tiempo más corto que si se hiciese
a temperatura ambiente, esto permite que la
demostración sea rápida y así se logra
mantener la atención de los alumnos. A continuación
adiciona el oxalato y ponga en marcha el cronómetro, la reacción
transcurre con un desvanecimiento progresivo del color del permanganato
hasta que la mezcla de reacción es incolora.

Fotografía 2

Fotografía 3

Fotografía 4

Fotografía 5

Fotografía 6
3) Haga el montaje de la fotografía 7. Indique a los alumnos que los reactivos
son los mismos que antes, pero que ahora se añade el catalizador que en nuestro caso ha sido 0,09 gramos de
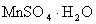 .
.

Fotografía 7
Los
reactivos son los mismos que en la fotografía
1, salvo que en el vidrio de reloj se ha puesto el catalizador
4) Añada en el vaso de reacción y
en el siguiente orden: el oxalato, el catalizador, y el ácido. Finalmente vierte el permanganato
y ponga en marcha el cronómetro. Observe que el tiempo de decoloración es
sensiblemente menor que en el caso anterior. La secuencia de la reacción aparece
en las siguientes fotografías

Fotografía 8

Fotografía 9

Fotografía 10

Fotografía 11
Notas para el
profesor.
a) Si la reacción la realizan grupos
de alumnos no se debe utilizar ácido
sulfúrico concentrado sino una disolución
1 M.
b) Es necesario saber el tiempo que tarda en decolorarse la reacción,
ya que si éste es demasiado largo,
el alumno tiende a perder la atención. Estimamos que el tiempo no debe superar
los tres minutos. Esto obligará a que el profesor haga ensayos previos antes
de poner la práctica en funcionamiento
con los alumnos.
c) No es necesario usar un agitador magnético cuando la práctica la realizan
los alumnos, basta agitar manualmente con una varilla de vidrio.
d) No es necesario que los alumnos pesen el catalizador, con usar una cantidad pequeña tomada con la espátula
es suficiente.
e) El alumno debe ir protegido con gafas de seguridad y bata de laboratorio,
las manchas de permanganato en la ropa son indelebles.
Sobre esta reacción existe abundante bibliografía. Recomendamos el artículo
Reduction of Permanganate: A Kinetics. Demonstration for General Chemistry
Margaret J. Steffel , George Volpe,J.Y.
Maloy
Publicado en la sección tested demonstration de la revista Journal
of Chemical Education Volumen 67 , número 7, julio 1990
![]() reacciona con el ión oxalato
reacciona con el ión oxalato
![]() en medio ácido sulfúrico
según la reacción global
en medio ácido sulfúrico
según la reacción global![]()
![]()










