Cinética
química de la reacción entre los iones yodato
e hidrogenosulfito (bisulfito)
OBJETIVOS
Preparar una disolución concentrada y a partir
de ella otra más diluidas.
Estudiar
experimentalmente una reacción reloj.
MATERIAL
Buretas (2)-Cuentagotas-tubo de ensayo-Vaso
de precipitados-Cronómetro
PRODUCTOS QUÍMICOS
-Disoluciones
de yodato de potasio de las siguientes concentraciones
0,040
M, 0,032
M, 0,024M, 0,020M, 0,016M, 0,012M,
0,008
M
-Disolución
de hidrogenosulfito que contenga menos de 0,8 g/L
En el comercio es más fácil y barato encontrar
metabisulfito de sodio Na2S2O5, el cual en
disoluciones diluidas está en equilibrio
con el hidrogenosulfito
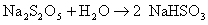
Este equilibrio está fuertemente desplazado
hacia la derecha, por tanto:
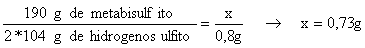
-Disolución de almidón
Esta
disolución se prepara colocando en un vaso 50mL de agua y se calienta hasta ebullición. Sobre ella se
añade unos cuatro gramos de almidón soluble y se forma una pasta, la cual
se añade sobre 500 mL de agua caliente. La adición se hace de forma lenta
y agitando hasta que la disolución quede transparente
FUNDAMENTO
La reacción global entre el ión yodato y el
hidrogenosulfito es:
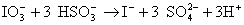
Como se ha puesto menos hidrogenosulfito que
yodato llegará un momento en que éste se gaste y en ese momento se produce
una reacción muy rápida
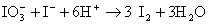
El yodo molecular es el que da la coloración
azul con el almidón.
2) Se repite la operación con las otras concentraciones
de yodato y se recogen los datos en una tabla
| Concentración de yodato |
t=Tiempo/s |
1/t en s-1 |
| 0,040 |
|
|
| 0,032 |
|
|
| 0,024 |
|
|
| 0,016 |
|
|
| 0,008 |
|
|
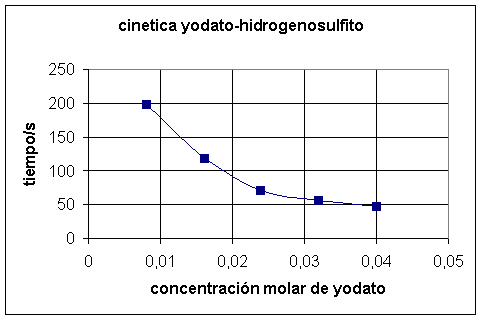
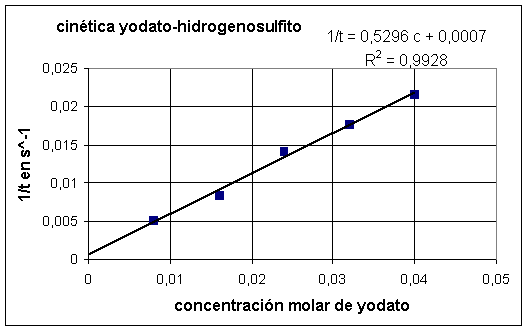
3) Con los datos anteriores se hacen dos representaciones
gráficas, una concentración (eje X) frente al tiempo (eje Y) y otra concentración
(eje X) frente al inverso del tiempo.
SOLUCIÓN
1) Los alumnos deben calcular que el hidrogenosulfito
está en una proporción menor que el yodato. Se realiza el cálculo
para la concentración menor de yodato
1
mol de yodato reacciona con 3moles de hidrogenosulfito
10 mL de la disolución de yodato 0,008 molar
son
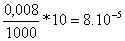 moles
moles
Para
reaccionar completamente estos moles se necesitan de hidrogenosulfito 24.10-4
moles, que son
24.10-4*104
= 0,25 g
como se ponen a reaccionar 10
mL con una concentración inferior a 0,8 g/L, se pone algo menos de 0,008
g, cantidad muy inferior a la necesaria.
Los
datos obtenidos en un experimento real fueron los siguientes
| Concentración
de yodato |
t=Tiempo/s |
1/t en s-1 |
| 0,040 |
46,4 |
0,0215 |
| 0,032 |
56,4 |
0,0177 |
| 0,024 |
70,6 |
0,0141 |
| 0,016 |
119,2 |
0,0084 |
| 0,008 |
198,4 |
0,0051 |
Gráficas
4) Si se desea preparar una sola
disolución de yodato 0,040 M el resto de las concentraciones se puede hacer
mezclando volúmenes de esta disolución
con agua
| Volumen total/mL |
Volumen de yodato/mL |
Volumen de agua/mL |
Concentración Molar |
| 10 |
10 |
0 |
0,040 |
| 10 |
8 |
2 |
0,032 |
| 10 |
6 |
4 |
0,024 |
| 10 |
4 |
6 |
0,016 |
| 10 |
2 |
8 |
0,008 |
![]()
![]()
![]()
![]()


