Pilas de concentración
En la pila Daniell, observábamos que se originaba una corriente eléctrica, por la diferente tendencia a ganar o perder electrones, de una sustancia sobre otra, debido a sus diferentes potenciales de reducción. Decíamos que el Cu2+ de una disolución de sulfato de cobre(II), ganaba 2 electrones pasando a Cu metálico, electrones que tomaba del Zn, que a su vez los perdía transformándose en Zn2+. Por este motivo mientras la disolución de sulfato de cinc se hacía mas concentrada, la de sulfato de cobre (II), se convertía en mas diluida, hasta que se igualaban los potenciales, momento en el que la diferencia de potencial se hacía 0, y la intensidad de la corriente también lo era.
Basándose en ello, se podría establecer una pila, con un mismo elemento, el cobre, en diferente concentración de sus sales. En este caso se convertiría en una pila de concentración.
En nuestro caso vamos a crear unas pilas de concentración Cu/Cu2+(0,1M)//Cu2+(1M)/Cu y Cu/Cu2+(0,01M)//Cu2+(1M)/Cu.
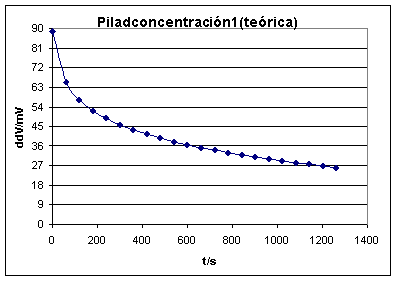
Al aplicar las expresiones de Nernst, al oxidante y al reductor (ver Pilas1),la expresión de la diferencia de potencial producida quedaría, teniendo en cuenta que se desplazan 2 moles de electrones por mol de cobre disuelto, sería:
![]()
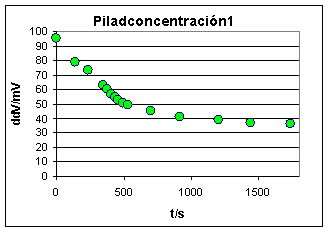
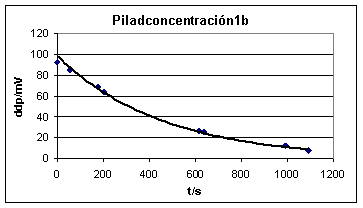
El problema de estas pilas es que la diferencia de potencial obtenida es siempre muy pequeña, y puede descender rápidamente en función del gasto energético que haga la corriente eléctrica producida.
En nuestro experimento hemos partido de una disolución saturada a 25ºC, de sulfato de cobre(II) pentahidratado, aproximadamente 0,9M, para obtener la disolución concentrada, y después hemos diluido a 10 y a 100, hasta obtener disoluciones 0,09M y 0,009M. Se distinguen fácilmente por la intensidad de su coloración azul, debido al complejo que forma el Cu(II), con 4 moléculas de agua.
En principio el montaje fue el que se observa en la figura 1 y 2.
Se dispuso de un cronómetro para averiguar la variación de la diferencia de potencial con el tiempo. Sin embargo se vio que no hacía falta ya que la fotografía digital con que se toman los datos, ya dispone de un cronómetro que indica con un error de +/- 1s, el tiempo en el que se hace cada foto, de forma que por diferencia, se puede hallar el intervalo entre valor y valor. Si no se empleara la fotografía digital para la toma de datos no quedaría más remedio que montar el cronómetro.