
Fig.2
GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
PRECIPITACIÓN DE
SALES DE PLATA 4
3.Nitrato de plata tiocianato…. cromato…..tiosulfato…..permanganato
Primeramente sobre la disolución
de nitrato de plata (fig.1), echaremos tiocianato potásico precipitando de forma peculiar, el tiocianato de plata AgSCN (Kps=1,3.10-12), dado lugar a una especie
de estalactitas blancas ( fig.2 y 3).

Fig.2

Fig.3

Fig.4

Fig.5
Si ahora se agrega una disolución de cromato potásico, se produce un precipitado de cromato de plata(Kps=1,12.10-12), de color anaranjado, y pequeños toques marrones (fig.4),que se va ennegreciendo, debido a la formación de óxidos e hidróxido de plata (Fig.5)
Si después echamos una disolución de tiosulfato sódico Na2S2O3, surge una disolución de coloración verdosa, y el precipitado naranja se concentra (fig.6, 7 y 8).
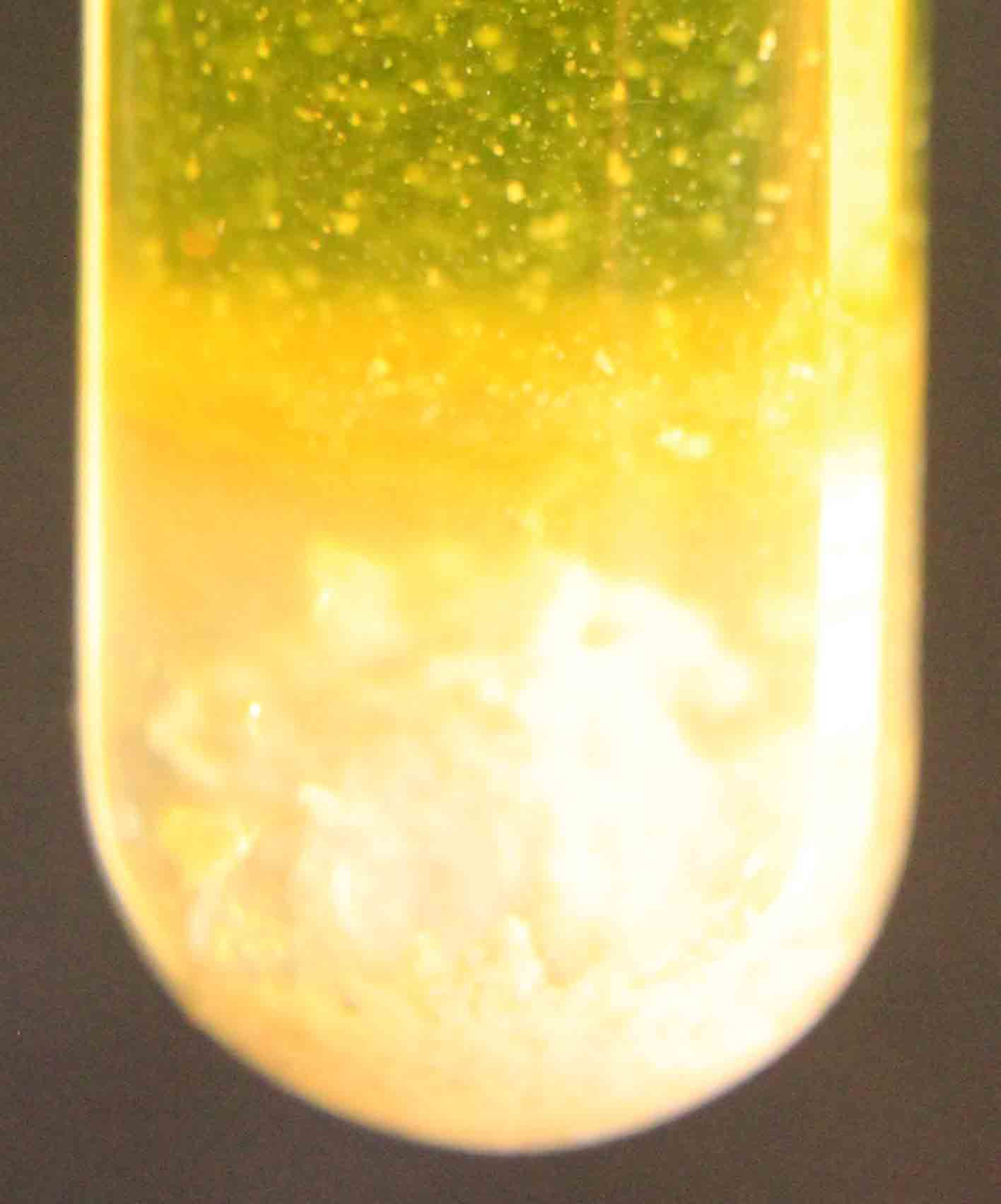
Fig.6

Fig.7

Fig.9
Finalmente al echar unos cristalitos de permanganato potásico y disolverse, el aspecto es el que presenta la fig.9. Naturalmente ocurrirá una reacción redox precipitando del MnO2 marrón, al reducirse el permanganato, y oxidarse el tiosulfato de plata, hasta sulfato o hidrógeno sulfato entre otras especies.
Las reacciones químicas que se producen son:
2Ag++K2CrO4 ![]() Ag2CrO4 +2K+
Ag2CrO4 +2K+
Las reacciones químicas que se producen son
Ag++KSCN ![]() AgSCN (Blanco) +K+
AgSCN (Blanco) +K+

Fig.1
