
Fig.2
GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Reacciones de
precipitación 8
Precipitación del Fe(III) (continuación)
Primeramente sobre una disolución saturada de sulfato férrico amónico (fig.1), echamos unas gotas de cloruro bárico, (fig.1-3), formándose un precipitado coloidal blanquecino (fig.2 y 3).

Fig.2
6-1d.jpg)
Fig.5
6-1.jpg)
Fig.4
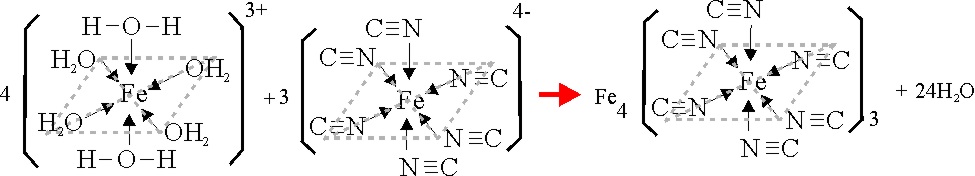

Fig.3 (detalle)
En otra disolución de sulfato férrico amónico se echan unas gotas de disolución de ferrocianuro
potásico K4(CN)6Fe, formándose un precipitado azul (fig.
4-7), que se intensifica al sustituirse los ligandos agua, por el grupo ciano según la reacción:
6-2.jpg)
Fig.6(detalle)

Fig.9 (detalle)
6-3.jpg)
Fig.7(detalle)
Otra reacción curiosa es con el ácido acetilsalicílico, en medio ácido (para romper el puente de hidrógeno intramolecular), con formación de un precipitado rojizo, pero que adquiere dos tonalidades, según esté disuelto o precipitado (fig. 10-13).La reacción es compleja ( sirve para el reconocimiento del Fe(III)), ya que el Fe3+sustituye los ligandos agua por carboxilfenoles de gran peso molecular.
Las reacción química que se produce es:
(NH4)Fe(SO4)2(ac)+2BaCl2(ac) ![]() FeCl3+NH4Cl+2BaSO4(s)
FeCl3+NH4Cl+2BaSO4(s)

Fig.10
Esta es la reacción de formación del conocido colorante azul de Prusia, colorante descubierto por el pintor alemán berlinés Heinrich Diesbasch, en 1704, que lo denominó azul de Berlín.

Fig.8
Si ahora se hace reaccionar con ácido tartárico, se obtiene un precipitado amarillo ( fig.8 y 9).

Fig.1

Fig.12(detalle)

Fig.11

Fig.13