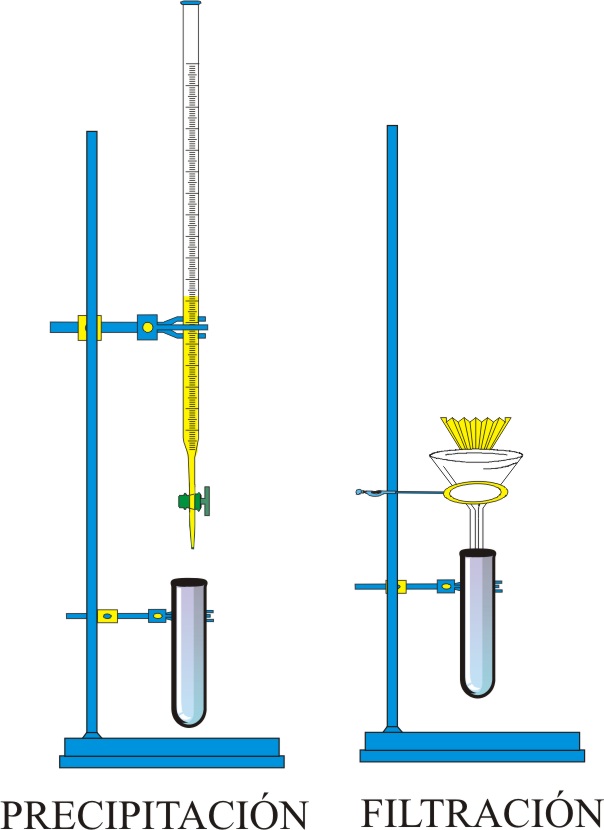
ESQUEMA DEL MONTAJE
GRUPO HEUREMA. EDUCACIÓN SECUNDARIA
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
ESTEQUIOMETRÍA DEL YODURO POTÁSICO Y EL NITRATO DE PLOMO (II)
INTRODUCCIÓN
Este experimento se divide en dos partes claramente diferenciadas
a) En la primera se proporcionan unos datos para que los alumnos realicen la práctica teóricamente, esto significa que no han de ir al laboratorio sino solamente manejar los datos y llegar a unos resultados.
b) La segunda parte exige ir al laboratorio y obtener los datos experimentales. Normalmente este experimento requiere alumnos avezados en el trabajo de laboratorio y además ser muy cuidadosos, si se desea que obtengan datos de calidad. También exige tiempo, ya que el precipitado ha de secarse, bien en estufa o al aire y en este último caso hay que esperar por lo menos 24 horas después del filtrado.
Si se desea un trabajo en equipo a cada grupo de alumnos se le confía
una sola medida y posteriormente se hace una puesta en común
OBJETIVO

ESQUEMA DEL MONTAJE
MATERIAL
Disolución de KI,
Disolución de
![]() ,
,
Tubo de ensayo de boca ancha, a ser posible que no sea muy alto
Embudo de cristal pequeño con lo necesario para realizar una filtración
Filtro de papel
Frasco lavador
Dos buretas
FUNDAMENTO
Una
disolución de KI reacciona con una de nitrato de plomo (II) de acuerdo con
la siguiente reacción igualada
2KI(aq) + Pb(NO3)2 ![]() 2 KNO3 (aq) + PbI2 (s)
2 KNO3 (aq) + PbI2 (s)
De ella se deduce que la relación de moles de
yoduro de plomo a yoduro de potasio es teóricamente ½ = 0,5.
PROCEDIMIENTO
1) Las disoluciones están contenidas en sendas buretas. Se añade en el tubo de ensayo de boca ancha 10 mL de la disolución de KI y a continuación, por ejemplo, 2 mL de la disolución de Pb(NO3)2 . El contenido del tubo se añade sobre el filtro y para arrastrar completamente el precipitado es necesario utilizar el frasco lavador. Después de la filtración en el papel de filtro queda el sólido húmedo. Se recoge el filtro y se deja secar poniéndolo sobre papel de filtro.
Si se hace una segunda medida
es necesario lavar el embudo y el tubo de ensayo. Esto hay que repetirlo tantas
veces como medidas se hagan.
La reacción
se realiza añadiendo siempre 10 mL de disolución de nitrato de plomo
2) Los resultados de un experimento real son
| Volumen KI/mL |
Masa de PbI2/g |
Número de moles de KI |
Número de moles de PbI2 |
Número de moles de PbI2 /número
de moles KI |
| 2 |
0,21 |
|
|
|
| 4 |
0,38 |
|
|
|
| 6 |
0,56 |
|
|
|
| 8 |
0,80 |
|
|
|
| 10 |
1,06 |
|
|
|
| 12 |
1,28 |
|
|
|
3) Completa las columnas que faltan en la tabla
anterior
4) Representa en el eje de las X el número de
moles de KI y en el eje de las Y el número de moles de PbI2. Determina
la pendiente de la recta
5) Calcula el error relativo en % que se ha
cometido en este experimento