
Fig.9 (detalle)
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
ALMACÉN

Fig.9 (detalle)
La reacción química que se produce es:
2NaOH+Cu2Cl2→ 2CuOH(s) +2NaCl
24.5. Precipitación de sulfuro de cobre(I)
Realizando la misma operación con Na2S, prácticamente no se
advierte precipitado (fig.4), salvo al cabo de varias horas (fig.5) .(Kps=6,27.10-9)

Fig.2( ampliación)
La reacción química que se produce es:
2 Na2S+Cu2Cl2 → Cu2S (s) +2NaCl
Reacciones de
precipitación 24
Precipitación del Cu(I). Continuación
24.4.Precipitación
del tiocianato de cobre(I)
Primeramente sobre una disolución saturada de cloruro de cobre(I) se echan unas gotas de disolución saturada de tiocianato potásico, formándose un precipitado amarillento de tiocianato de cobre (I) (fig.1 y 2).(Kps=1,27.10-12) frente a la disolución verdosa
ALMACÉN
Aproximación al Número de Avogadro
Reacciones de precipitación de sales de plata(I)
Reacciones de precipitación de sales de plata(II)
Reacciones de precipitación de sales de plata(III)
Reacciones de precipitación de sales de plata(IV)
Reacciones de precipitación de sales de Hg(II) y Cu(II), I
Reacciones de precipitación de sales de Hg(II) y Cu(II), II
Reacciones de precipitación del Fe(III), I
Reacciones de precipitación del Fe(III), II
Reacciones de precipitación del Fe(II)
Reacciones de precipitación del Ni(II)
Reacciones de precipitación de hidróxidos I
Reacciones de precipitación de hidróxidos II
Reacciones de precipitación del Co(II) Primera parte
Reacciones de precipitación del Co(II) Continuación
Reacciones de precipitación de Hg(I)
Reacciones de precipitación del Hg(II)
Reacciones de precipitación del Pb(II)
Reacciones de precipitación del Pb(II) continuación
Reacciones de precipitación del Ba(II)
Reacciones de precipitación del Ba(II) continuación
Reacciones de precipitación del Cd(II)

Fig.5
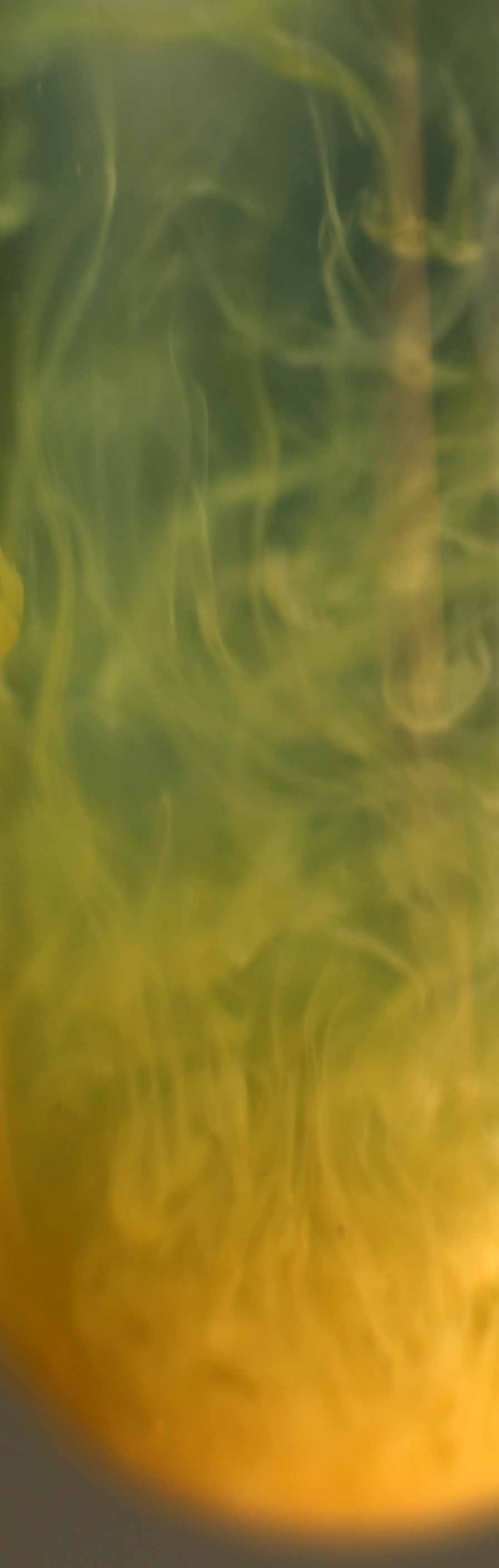

Fig.4
23.7. Precipitación del
carbonato de cobre(I)
Si echamos sobre una
disolución saturada de cloruro de cobre(I), unas gotas de disolución saturada
de carbonato sódico, no se aprecia formación de precipitado.

Fig.7 (detalle)
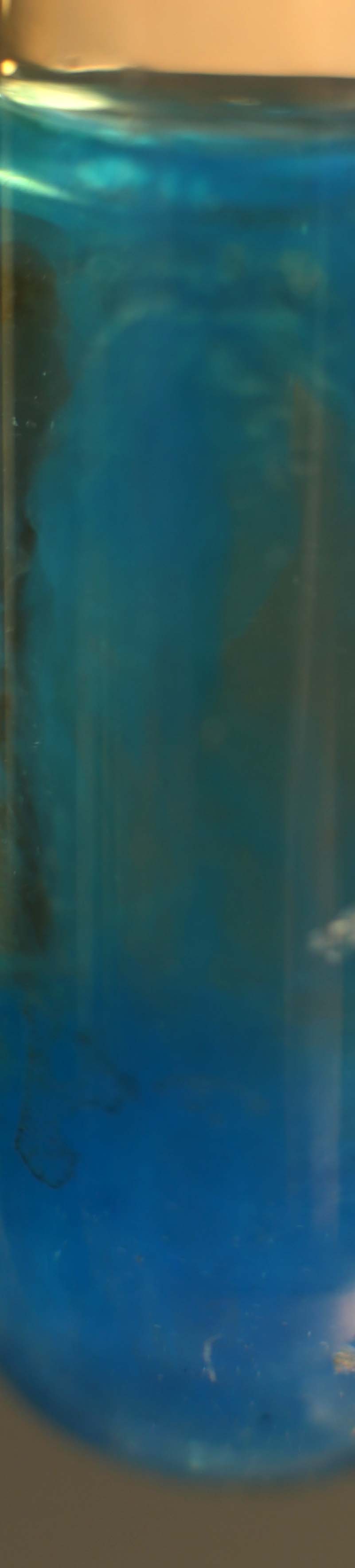
Fig.6

Fig.3( Ampliación)
La reacción química que se produce es:
KSCN+Cu2Cl2 → 2CuSCN(s) amarillo) +2KCl
23.6. Precipitación del
hidróxido de cobre(I)
Si echamos sobre una disolución saturada de
cloruro de cobre(I), unas gotas de disolución de hidróxido sódico 6N, se
observa un precipitado azulado posiblemente por oxidación parcial del Cu(I) a
Cu(II)

Fig.8 (detalle)