Fig.47
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
ASPECTOS ATÓMICOS DEL HIERRO EN
LA VIDA DEL HOMBRE (final)
Los venenos del hierro
Hasta ahora hemos seguido, desde
el interior, el comportamiento del ion ferroso, la joya de nuestra corona,
en su papel vitalizador, esto es, captando al oxígeno, ya como aducto, ya
integrándolo en una formación octaédrica normal, para así transportarlo a
los diferentes tejidos de nuestro cuerpo. Sin embargo, hemos de tener en cuenta
que el mecanismo explicado no sólo afecta al oxígeno, sino a otras muchas
moléculas gaseosas, que dispongan de una distribución electrónica apropiada
para la formación de enlaces coordinados, y por lo tanto el oxígeno puede
entrar en competición con desventaja frente a ellos; es evidente que los únicos
perjudicados somos nosotros que nos jugamos la vida. Hasta hace cuestión de
50 años, el sistema más empleado por los norteamericanos para suicidarse era
la inhalación del monóxido de carbono desprendido por los tubos de escape
de los vehículos dentro de garajes cerrados.
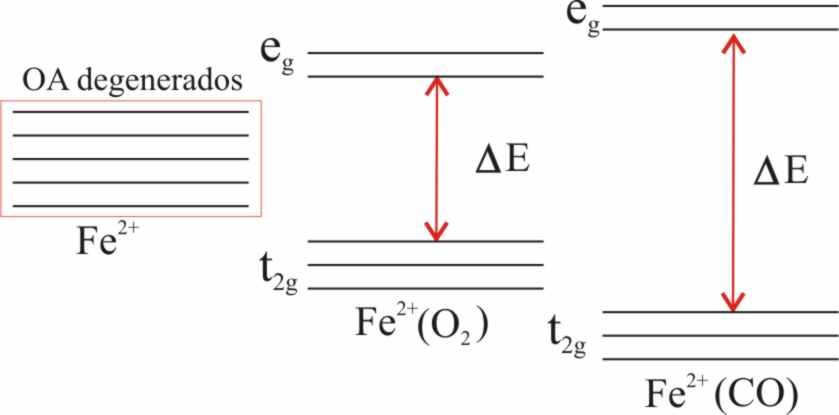
Vamos a introducirnos dentro de la cavidad, y observar el comportamiento del ion ferroso, enganchado al hemo y algo encima de su plano, y con el seguro superior de la histidina proximal, cuando por su parte inferior se le aproxima una molécula pequeña y extremadamente incordiante como el monóxido de carbono. Esta molécula dispone de 14 electrones en total y 10 en el nivel externo, con un orden de enlace de 3, y está en el extremo de la serie espectroquímica, lo que indica su gran actividad, capaz de desdoblar los orbitales atómicos del ion ferroso mucho más que el propio oxígeno (fig.47).
ALMACÉN
El modelo atómico de Bohr en su punto justo
Orbitales s con ayuda de la hoja de cálculo Excel
Orbitales atómicos hidrogenoides p
Orbitales atómicos hidrogenoides d (Primera parte)
Orbitales atómicos hidrogenoides d (continuación)
Orbitales atómicos hidrogenoides f (Primera parte)
Orbitales atómicos hidrogenoides f (continuación)
La curiosa historia del berilio (primera parte)
La curiosa historia del berilio (continuación)
La curiosa historia del berilio( final)
Aspectos atómicos del hierro en la vida I
El hierro en la respiración humana
Efecto Rube Goldberg del hierro en la sangre

Fig.47
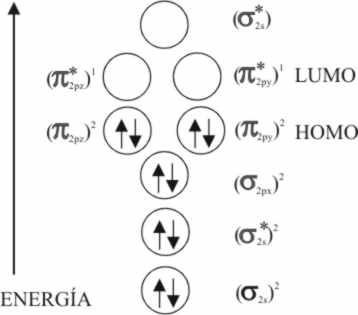
Fig.51
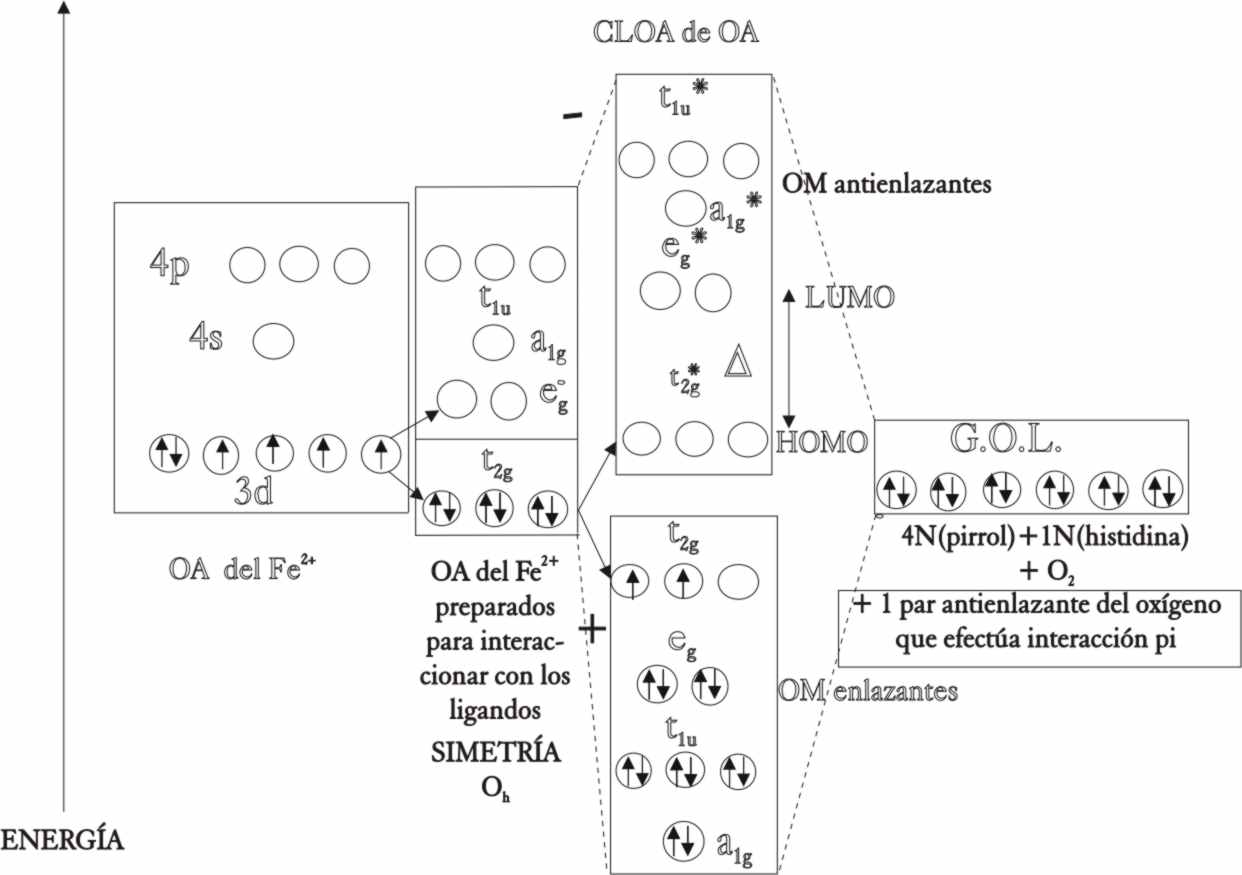
Fig.53
Este hecho desencadena una serie
de acciones:
a) El ion ferroso dispone sus seis electrones en los tres orbitales de
menor energía, con lo cual forma un complejo de orbital interno, con menor
radio y diamagnético.
b) Al disminuir su radio, desciende tal como ocurría con el oxígeno,
provocando el efecto Rube Goldberg
c) Sin embargo el ángulo Fe-C-O será de 1801, por proceder de una molécula
con un triple enlace, dos π y uno σ, como el CO.
d) La distancia de enlace Fe-C es menor que en el caso Fe-O, aproximadamente de 1,8Å, lo cual implica una mayor intensidad de la fuerza de enlace (fig.48).
e)
Esta mayor fuerza de enlace, y
menor energía, está justificada por la posibilidad de formación de estructuras
resonantes tales como Fe=C=O y Fe-C=O. En el primer caso, el carbono debilita
su enlace con el oxígeno pues debe dejar un orbital p libre para formar
el enlace π con el orbital d del metal
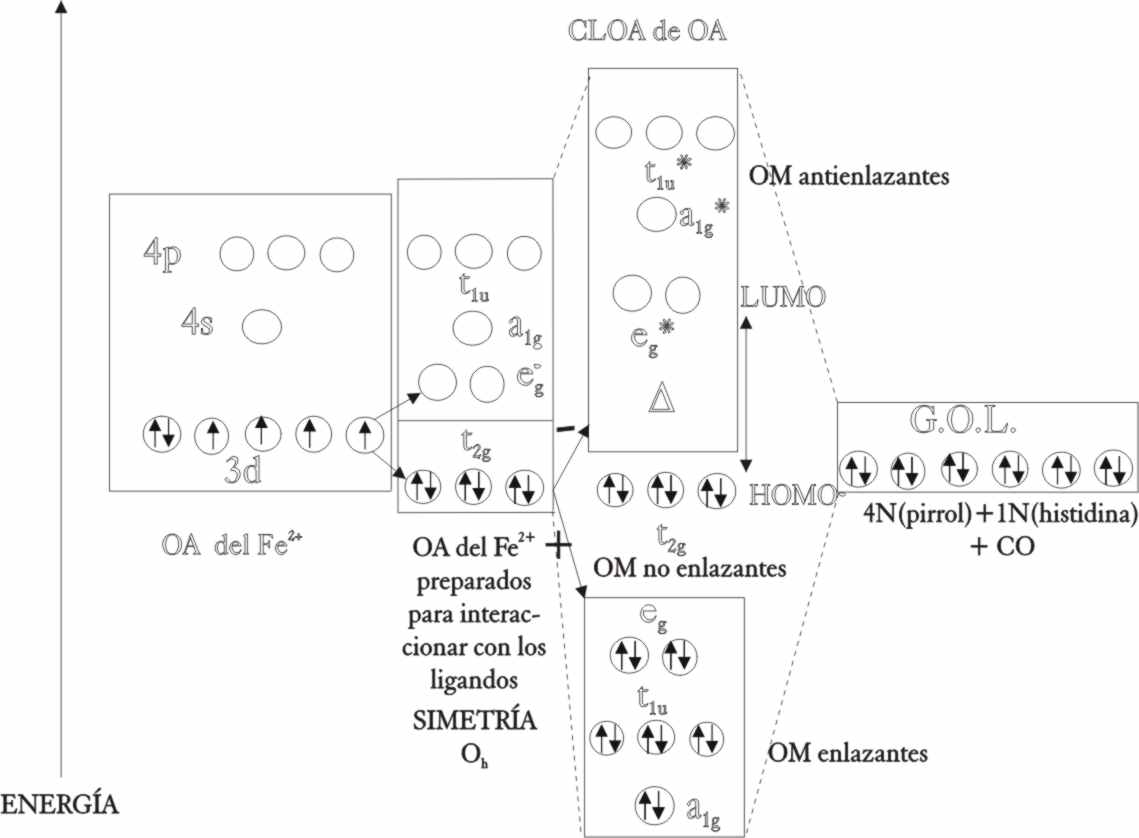
Fig.50
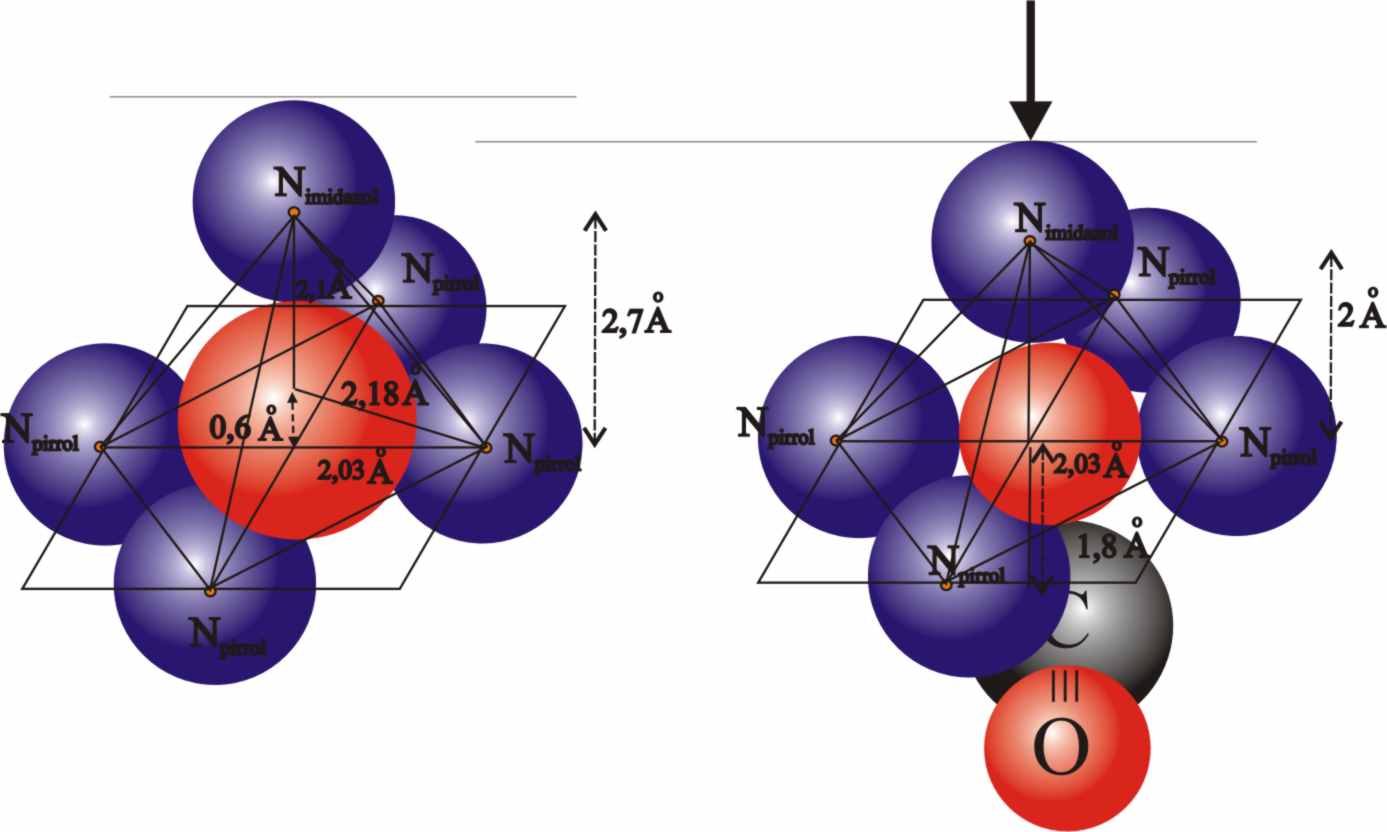
Fig.48
La formación de orbitales moleculares
sigue los mismos pasos que se emplearon para el oxígeno. Los OA del ion ferroso
eg, 4s y 4p, "cloarán" con los de los 6 CO, con la simetría
adecuada, produciéndose 6 OME, en los que se introducirán los 12 electrones
de los 6 CO, con la siguiente distribución de menor a mayor energía : (a1g)2,
(t1u)6, (eg)4. Los t2g,
serán no enlazantes y albergarán los 6 electrones d del ion ferroso, formando
el HOMO del complejo. Los OMNE, por orden energético (eg)*,
(a1g)*, (t1u)*, estarán vacíos,
siendo el primero de los dados el LUMO del complejo (fig.50).
Fig.49
Debido a estas interacciones π,
la fuerza de enlace aumenta y también lo hace la energía de desdoblamiento
entre el nuevo HOMO, de menor energía y el LUMO, eg* cuya posición
energética no ha variado. La mayor absorción de energía hace que la carboxihemoglobina
formada sea rosa.
Si comparamos el proceso de formación del complejo con el CO con el que se podía establecer con el O2, observaremos que éste dispone de 12 electrones en el nivel de valencia para distribuir en los correspondientes OM. Su orden de enlace es 2 [1] . El HOMO es un π* que alberga 2 electrones.
Aparte de estos enlaces todos ellos
del tipos sigma, se va a producir una retrodonación de los electrones no enlazantes
t2g sobre los π antienlazantes del monóxido de carbono. Los
dos átomos que forman dicha molécula disponen de 10 electrones en el nivel
de valencia que deberán acondicionarse en los OM correspondientes. De la forma siguiente
CO: (KK')4, (σ2s)2, (σ2p)2,
(π2p)4. Su orden de enlace es 3, siendo su LUMO,
el π* muy apto, por ser perpendicular a los enlaces σ, para interaccionar de forma π con los t2g
no enlazantes del metal que posean la simetría adecuada (fig.51).
De esta forma, la combinación lineal
(CLOA) de los ONE t2g del Fe2+ con otros 3 t2g
del CO, producirán 3 OM t2g
enlazantes de menor energía que los procedentes del metal y otros 3 t2g*
de mayor energía que en este caso no alcanzan gran importancia pues no se
ocuparán. Por lo tanto los 6 electrones del metal que integraban el HOMO t2g
no enlazante, cuando no se consideraba la interacción π pasan a ser un
nuevo HOMO t2g π enlazante al tenerla en cuenta (fig.52).
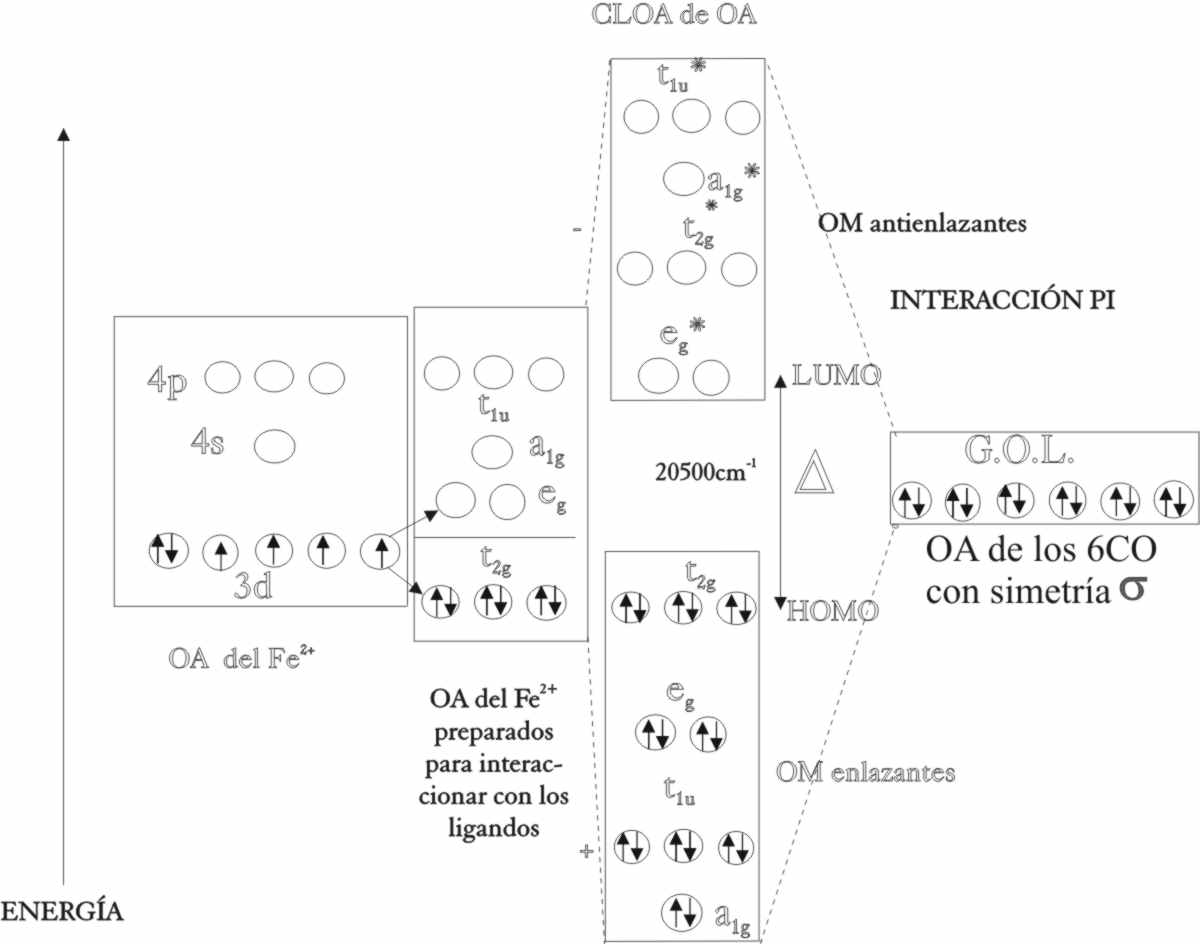
Fig.52
Dado que sólo los OM π* de
la molécula del ligando, tienen la
simetría adecuada para elaborar los OM π del complejo, con los t2g
no enlazantes del metal, serán los que podrán "cloar", produciéndose
3 OM t2g enlazantes y otros 3 t2g antienlazantes con
menor energía que los eg del complejo que han permanecido invariables.
En los 3 primeros se alojarán los
6 electrones del metal, pero quedan otros 2, los procedentes de los orbitales
antienlazantes del ligando oxígeno que no tienen más remedio que ir ocupando
los OM π t2g* del complejo. De esta forma el HOMO de dicho
complejo será el t2g *, mientras que el LUMO seguirá siendo el eg de forma invariable.
La consecuencia de todo ello será que la energía de desdoblamiento, mejor llamada en este caso, energía de promoción
disminuye debilitándose el enlace (fig.53).
Por eso el ión ferroso prefiere al monóxido del carbono, dejando
al oxígeno, hasta tal punto que su afinidad es 300 veces superior, sustituyéndolo
y provocando la muerte por incapacidad del ion ferroso de acomplejar al
oxígeno y por lo tanto transportarlo
con la sangre a los tejidos. También, en
mecanismos vitales, se producirá de una forma interna, monóxido de
carbono, que será captado preferentemente por nuestra hemoglobina, así el
1% de dichas moléculas son incapaces de transportar oxígeno por tener ocupado
el ion ferroso su sexta posición de coordinación con el citado óxido de
carbono, sin que notemos ninguna sensación de asfixia.
Concluyendo nuestro desarrollo hemos demostrado que el motivo profundo
del envenenamiento con CO es simplemente porque su molécula tiene 10 electrones
de valencia mientras que la de oxígeno, con volumen y densidad semejante,
lo supera en 2.Estos dos electrones, al entrar en un orbital molecular antienlazante,
modificarán las interacciones con los del ion ferroso haciéndolas más débiles
)Cómo volver a la vida? Habrá que
intentar sustituir el CO por el O2
. Lo haremos desplazando el equilibrio de absorción de formación de carboxihemoglobina,
por aplicación del Principio de Le Chatelier, o sea haciendo respirar oxígeno
puro, rápida y profundamente.
[1]
El orden de enlace
de determina a través del n'1 de electrones
en OM enlazantes - n1 de electrones
en orbitales antienlazantes dividido todo por 2, y es el que determinará
que el CO con 10 electrones en el nivel de enlace tenga un triple enlace,
por no ocupar los OM antienlazantes, mientras que el oxígeno, al ocuparlos
lo establece doble.