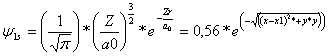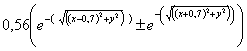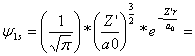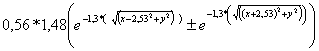ENSEÑANZA
DE LA FÍSICA Y LA QUÍMICA
sección:
TEMAS DE FÍSICA Y QUÍMICA
Orbitales moleculares I
Introducción
a laTeoría de orbitales moleculares. Aplicación a moléculas homonucleares
sencillas.
La teoría
de orbitales moleculares (OM) para describir un enlace covalente nace unida
a la de orbitales atómicos (OA), y con su
misma filosofía. Es elaborada por Hund, Lennart-Jones y Mulliken, entre 1928
y 1932.
La función de onda que representa al OM, a partir
de la cual se determina su energía, se puede calcular de muchas maneras pero
la más general se obtiene por combinación
lineal de sus orbitales atómicos (CLOA), o sea por suma o resta de las funciones
atómicas (idea de Mulliken), dado que al aproximarse los OA de un
átomo X a los de otro igual y superponerse, los electrones están controlados
por la interacción nuclear de uno u otro núcleo la mayoría del tiempo. La
suma produce los OM enlazantes (OME), mientras que la resta da lugar a los
OM antienlazantes (OMAE). Ahora bien para
realizarla deberán cumplirse los requisitos inherentes a toda la teoría
cuántica del enlace covalente: superposición de los OA de energía y simetría
semejante, así como los característicos de la teoría atómica: Principio de
Exclusión de Pauli y leyes de Hund.
Los OA,
venían caracterizados por dos números cuánticos n y l, que determinaba su
forma ( l=0, OA s, l=1 OA p, l=2 OA d). En los OM,
se conservan los números cuánticos n y l que corresponden a las funciones
atómicas que se combinan, incrementado en el número cuántico l característico
del OM, que cuantifica el momento angular molecular respecto al eje de enlace de la molécula, y
que también determina la forma, debiendo tomar valores equivalentes al módulo
de los que tomaba m como se aprecia en la tabla siguiente. La comparación entre los números cuánticos atómicos
de los electrones de X y moleculares de X2, implica:
| X |
X2 |
| n |
l |
m |
OA |
Nºe |
l |
OM |
NºeE |
NºeAE |
| 1 |
0 |
0 |
1s |
2 |
0 |
s |
2 |
2 |
| 2 |
0
1 |
0
1,0,-1 |
2s
2p |
2
6 |
0
0
1 |
s
s
p |
2
2
4 |
2
2
4 |
| 3 |
0
1
2 |
0
1,0,-1
2,1,0,-1,-2 |
3s
3p
3d
|
2
6
10 |
0
0
1
0
1
2 |
s
s
p
s
p
d |
2
2
4
2
4
4 |
2
2
4
2
4
4 |
En el caso de la molécula
de hidrógeno (H2), el CLOA de las y individuales produciría la función de onda molecular f = ayA ± b yB
,
considerando los hidrógenos A y B, y a y b los coeficientes de participación
de los respectivos y atómicos en la función de onda molecular, que en este caso
serán iguales al serlo los OA. La suma produce el OM enlazante que se denominaría s1sE y la resta,
el antienlazante s1sAE de mayor
energía. En este caso los dos electrones 1s que la forman cubrirían el OM
de menor energía, o sea el s1sE que genéricamente se denomina con las siglas
inglesas de HOMO (orbital molecular ocupado de mayor energía), mientras que el s1sAE quedaría desocupado de
electrones, y sería el LUMO (orbital molecular vacío de menor energía) (fig.1)
Los números cuánticos (n,l,
l, s) de los electrones
en dicho OM, serían (1,0,0,½ ) y (1,0,0,-½ ), o sea siguiendo el Principio
de Exclusión de Pauli, tendría capacidad para dos electrones (general para
cada OM).
El nivel energético que
proporcionaría el s1sE sería de
337 kJ/mol, mejor que la obtenida a través de la TEV (Teoría del enlace
de valencia) de 303kJ/mol, pero todavía
lejos de su valor experimental, 458kJ/mol.
Representación
de funciones de onda moleculares y densidades de probabilidad
Conocemos que
para el átomo de hidrógeno
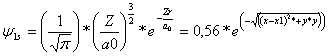
Teniendo en cuenta que Z (carga
nuclear efectiva) =1
Y que el radio covalente experiental
del H2 es 37pm, y que por lo tanto la distancia entre las posciones
de los núcleos de H deberá ser 74pm, en función del radio de Bohr (53 pm)
será 1,49 bohr. Por lo tanto las funciones de los OM a representar serán las
combinaciones lineales:
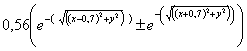
distribuyendo
los 1,49 bohr a un lado y a otro de la posición central
La suma proporcionará el OM F1s enlazante y la resta el F1s antienlazante
Las gráficas
obtenidas de los OM y las curvas de
nivel, serán fig 2,3,4 y 5, referidas como siempre
a distancias bohr
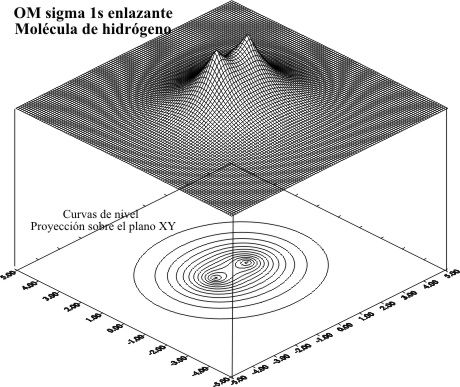
Fig.2
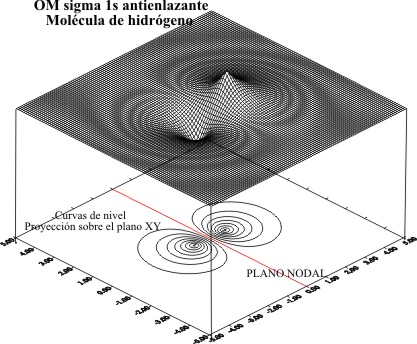
Fig.4
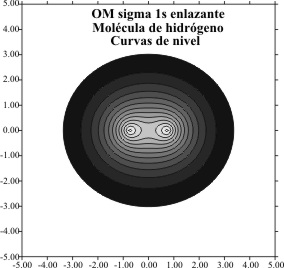
Fig.3
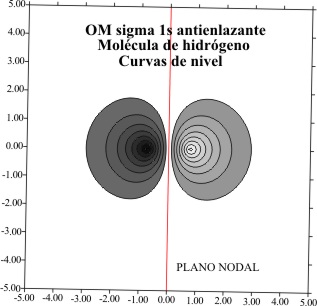
Fig.5
Si elevamos las funciones al cuadrado para determinar
las densidades de probabilidad se obtienen las gráficas respectivas que copmo
se aprecia difieren poco de la descripción de los OM ( fig 6, 7, 8 y 9).
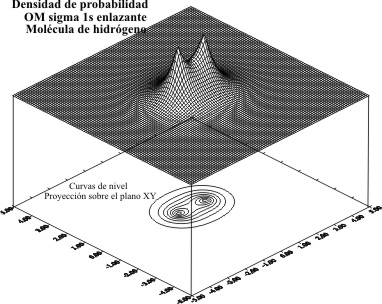
Fig.6
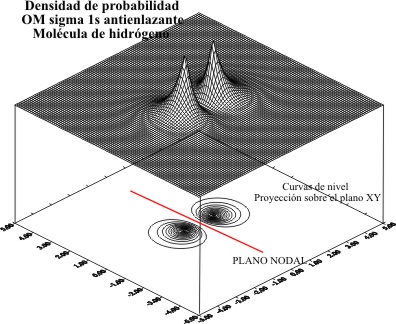
Fig.8

Fig.7
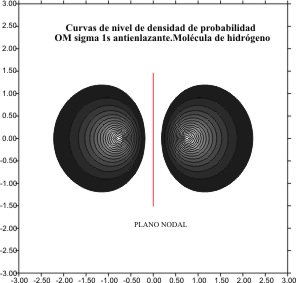
Fig.9
Tópicos de
la descripción de OM
Es muy curiosa
la descripción gráfica de los orbitales moleculares (OM) en los textos en
Enseñanzas Medias. Al aplicar el método CLOA (combinación lineal de orbitales
atómicos), siempre se toman los orbitales atómicos hidrogenoides, aunque la
molécula de hidrógeno no excitada no forme enlaces con combinaciones lineales superiores al 1s.
Sin embargo en los dibujos apreciamos la forma de los orbitales moleculares
F2s, F2p
e incluso los B2p propocionados
por las combinaciones lineales de los OA del hidrógeno que son sólo teóricas
e inexistentes en la práctica.
Este es el
primer tópico que surge en los textos, el segundo es creer que los OM moleculares
del mismo tipo tienen la misma forma o son aparentemente iguales.
En este trabajo
vamos a comparar los OM, formados por combinaciones lineales de átomos no
hidrogenoides, comparados con los hidrogenoides ( que
aparecen en los textos).
Si aplicamos todo lo anterior a la posible
molécula de Li2, la función de onda átomica generalizada
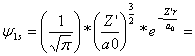
vendría
modificada no sólo por los valores
de r ( la distancia de separación aumenta) sino sobre todo por los de de Z’
(carga nuclear efectiva), con lo cual el segundo factor ya no es 1 , como
en el caso del H
Con lo que la combinación lineal
para el Li2, de orbitales 1s, proporciona una función
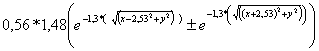
Si la elevamos al cuadrado para calcular la
densidad de probabilidad y compararla con la del H, para estos mismos OA,
se obtendrían las gráficas siguientes
( fig.10,11,12,13)
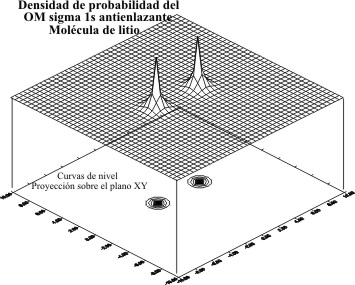
Fig.12
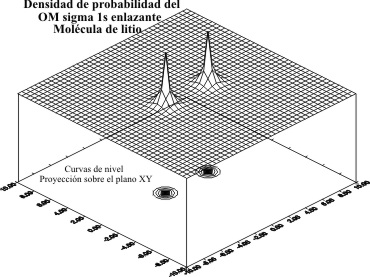
Fig.10

Fig.13

Fig.11
¿Qué significa esto?.
Pues sencillamente que al fijar los núcleos de los átomos de Li, a la distancia
internuclear experimental, los OA 1s, no superponen, y por lo tanto no se
puede hacer la combinación lineal. Por eso al no existir esta, no hay enlace
entre ellos; son OM no enlazantes. Si creemos que a lo mejor, al aumentar
la carga nuclear efectiva y disminuir la distancia de enlace, avanzando hacia
la derecha en el sistema periódico a
lo mejor conseguimos la combinación lineal, estamos equivocados, como puede
verse al aplicar la teoría a la combinación lineal de las funciones 1s para
la molécula de oxígeno (fig.14)
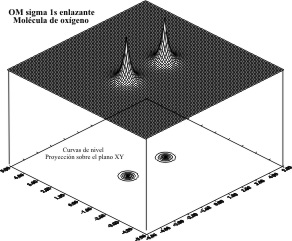
Fig.14
Esto ocurriría con todos los elementos del segundo
período y por lo tanto con los demás.
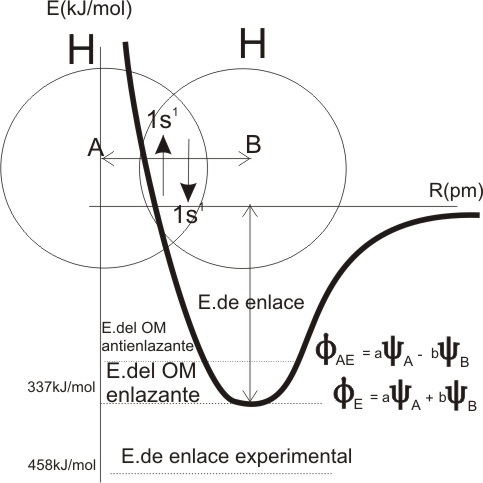
Fig.1