ENSEÑANZA
DE LA FÍSICA Y LA QUÍMICA
sección:
TEMAS DE FÍSICA Y QUÍMICA
ORBITALES ATÓMICOS
HIDROGENOIDES tipo f
(primera parte)
Por lo general
en el bachillerato, los profesores dejan al margen de sus explicaciones los
orbitales f. Describen los d, estudian
los problemas que encierran, y se marginan los f, calificándolos como muy
complejos. Se argumenta que tampoco se van a explicar los elementos cuyos electrones completan esos orbitales, aunque
se estudien otros que sí los han rellenado. Al ser unos orbitales internos,
no superponen con otros orbitales y por lo tanto no dan lugar a enlaces. Por
eso no son importantes.
Es evidente
que se supone una pérdida de tiempo explicar los orbitales f en bachillerato,
porque realmente su descripción es compleja. Se definen a partir de unas condiciones
cuánticas n=4, l=3, que implican la existencia de 3 planos nodales en cada
orbital. Esto provoca dificultades al dibujarlos.
La función
radial 4f, tiene por ecuación
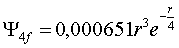
Si se representa en una hoja de
cálculo produce la siguiente gráfica (fig.1):
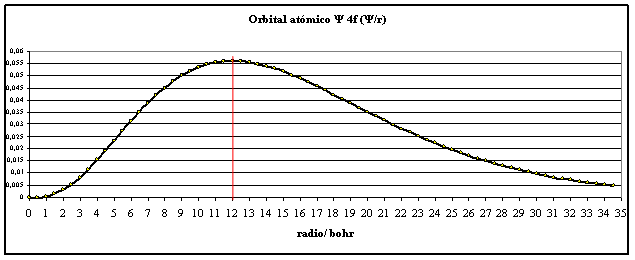
Fig.1
Con
una densidad de probabilidad r2
R2 ( fig.2)
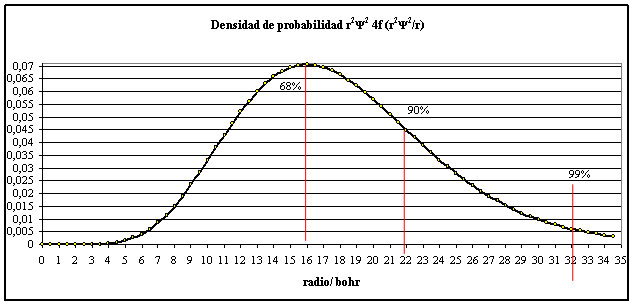
Fig.2
A 16 bohr, existe un máximo de
densidad de probabilidad, que como se ve en las gráficas de probabilidades
acumulativas abarca el 68%.
La gráfica de probabilidad acumulativa es:
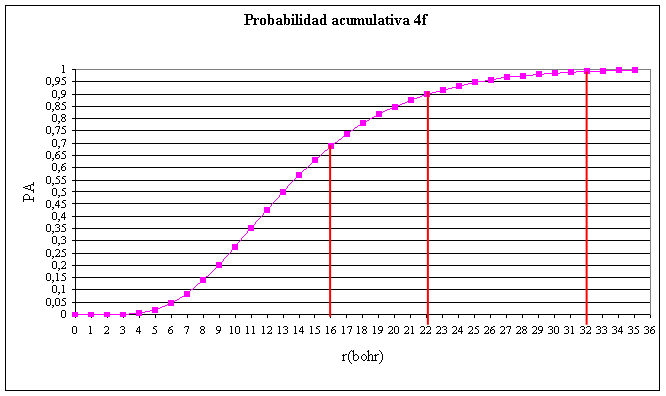
Fig.3
Si comparamos con la gráfica 4d
(orbitales atómicos d, primera parte), observamos que en la 4d, el máximo
tenía lugar a 22 bohr, mientras que en el 4f ocurre a 16 bohr
; es más interno. En el 4d, existe un punto nodal a 12 bohr, mientras
que en el 4f no existe, dado que n-(l+1) = 0.
El 90% de probabilidad se encuentra
encerrado en un volumen de radio 22 bohr, mientras que en el 4d, el radio
que encerraba dicho porcentaje era de 30 bohr.
Donde se dan las mayores diferencias
es en la función angular, y por lo tanto en la forma del propio orbital. Ya
se ha explicado que depende de los valores de m, que en este caso pueden ser
siete: ±3, ±2, ±1 y 0. Por lo tanto existen 7 orbitales 4f.
Estudiaremos primero aquellos
orbitales 4f condicionados por m = 0, m = ±1.
En el primer caso el orbital atómico
recibe el nombre de 4fz3. Suele recibir este nombre debido al término
con mayor exponente que aparece en la
función o con el producto de las variables que lo definen, como va a ocurrir
en la mayoría de los OA 4f.
La función angular es, en coordenadas
rectangulares:
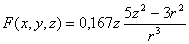 ,
,
que modificada
teniendo en cuenta que
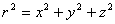 ,
,
y después
de incorporar la parte radial común a todas, produce una función R4f(4,3,0) que al representarse mediante
un programa matemático, genera el siguiente gráfico superficial (para reducir
una dimensión y representar las características más sobresalientes del orbital,
proyectamos sobre los ejes “y” y “x” el corte de la función de ondas cuando
y=z).
En las figuras 5 y 6, se dibujan
la función superficial (fig 4) y su proyección o mapa de contorno (fig.5).

Fig.4
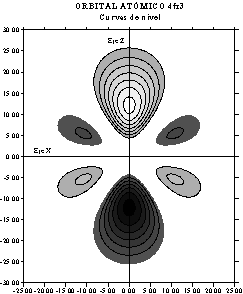
Fig.5
Se
observan perfectamente los 3 planos nodales característicos.
La
gráfica de la densidad de probabilidad R2 y su línea de contorno se dan
en las fig.6 y 7.

Fig.6

Fig.7
La línea de contorno marca el dibujo
del OA 4f. Como se observa, no sería muy difícil de dibujar para un alumno
de Enseñanzas Medias.
Con las condiciones
cuánticas n = 4, l = 3, m = ±1, se tienen los denominados orbitales 4fx3
y el 4fy3, que son exactamente iguales aunque orientados en los
ejes dominantes (los que le dan el nombre).
La funciones
angulares respectivas en coordenadas rectangulares son:
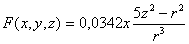 y
y
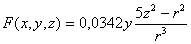
Operando como en el caso anterior, produce los siguientes
gráficos para R4f(4,3,±1)
(fig 8 y 9).

Fig. 8

Fig.9
Este orbital atómico se conoce
con el nombre de 4fx3.
La representación del OA 4fy3,
sólo cambiaría el eje x por el y, al tener en cuenta la simplificación de
ejes.
Al elevar al
cuadrado las funciones anteriores, y representarlas, se obtienen las figuras
10 y 11. La 11 corresponde a las curvas de nivel de densidad de probabilidad,
cuya línea de contorno definiría el dibujo del orbital atómico.

Fig.11

Fig.10
![]()










