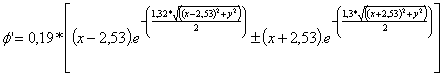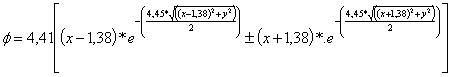ENSEÑANZA
DE LA FÍSICA Y LA QUÍMICA
sección:
TEMAS DE FÍSICA Y QUÍMICA
Orbitales moleculares III
Tópicos
de la descripción de OM F 2p
1.El modelo hidrogenoide
Si se aplica el sistema
empleado en OM1 y OM2, veremos primero los OM hidrogenoides, que se representarán
a partir de la combinación lineal de OA 2px. Para ello se tomará la función
atómica
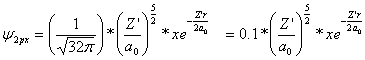 (1)
(1)
Aplicándola al H; Z’=1,
a0=1, y la posición de los núcleos sobre el eje X, en unidades bohr en x+0,75
y x-0,75.
Obteniéndose las dos funciones
enlazante y antienlazante:
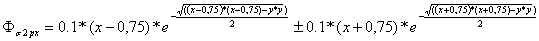
que representadas
producen las figuras 1 y 2
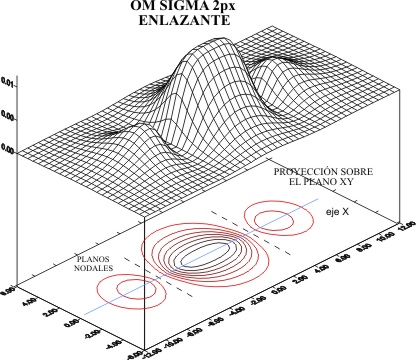
Fig.1
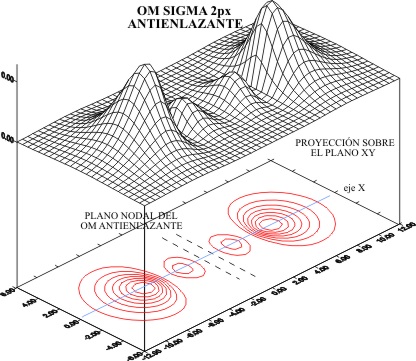
Fig.2
En las proyecciones sobre el plano
XY, se aprecian perfectamente en el fig 1, los dos planos nodales procedente
de los OA 2px, que hereda el OM. En cambio en el caso del OM antienlazante
(fig.2). Hay el plano nodal molecular y los dos atómicos, o sea que existen
tres planos nodales.
2. Moléculas homonucleares de
átomos no hidrogenoides
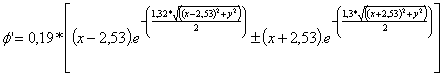 Si en la ecuación 1, se introducen para cada elemento los parámetros de Z’,
y las distancias correspondientes al radio covalente de cada elemento, para
una hipotética molécula Li2, tendríamos unas funciones de
onda moleculares:
Si en la ecuación 1, se introducen para cada elemento los parámetros de Z’,
y las distancias correspondientes al radio covalente de cada elemento, para
una hipotética molécula Li2, tendríamos unas funciones de
onda moleculares:
Al
representarlas se obtienen las figuras 3 y 4 para la combinación antienlazante
y 5 y 6 para la enlazante
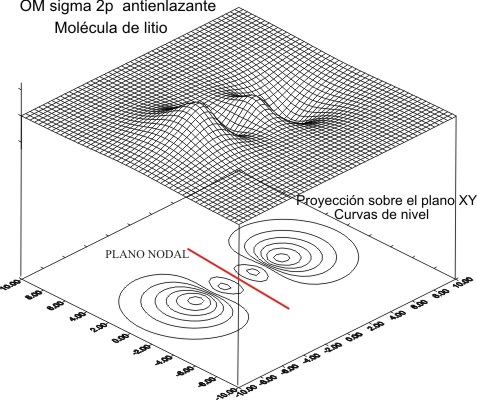
Fig.3
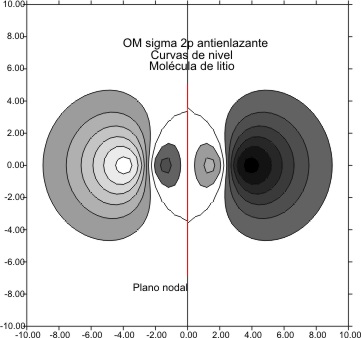
Fig.4
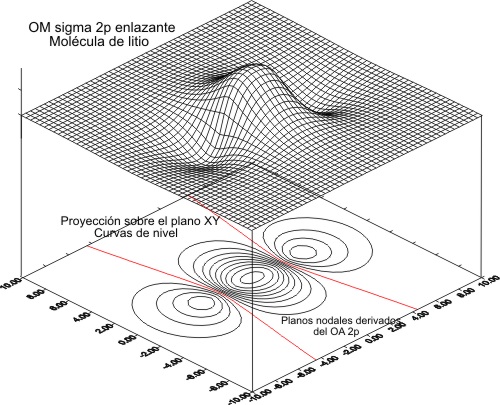
Fig.5
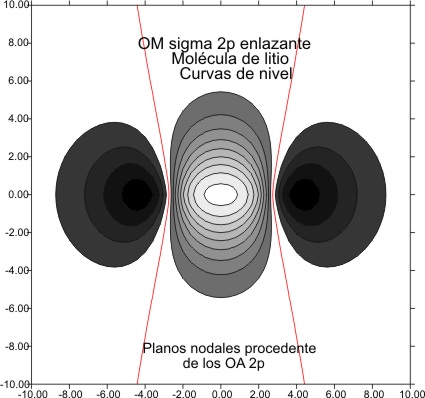
Fig.6
Las curvas de nivel (fig
4 y 6), permiten diferenciar perfectamente estos OM
Al trasladarnos a otros elementos del segundo período,
hacia la derecha del litio, observaremos la disminución del tamaño. Por ejemplo
para el caso de los OM F 2p para el nitrógeno ,
el antienlazante (fig 7 y 8) y el enlazante (fig 9 y 10)
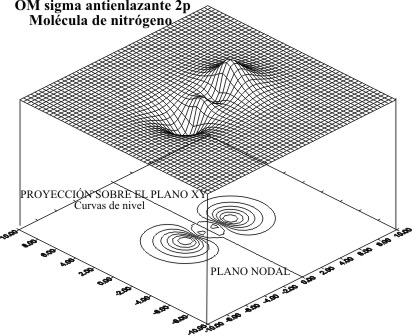
Fig.7
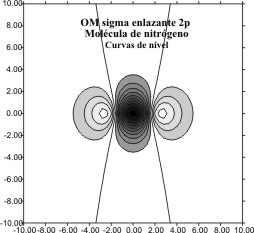
Fig.10
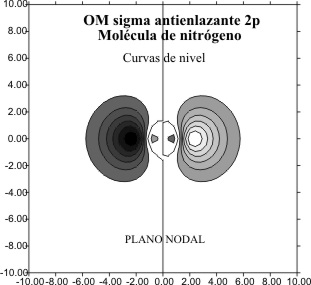
Fig.8
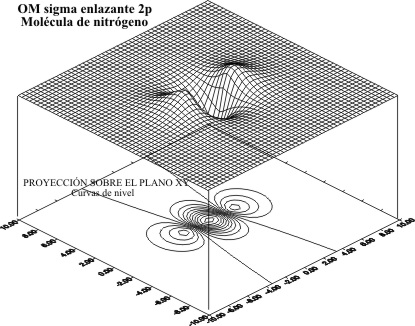
Fig.9
Se puede comparar el tamaño del OM
desde el Li2 al N2, relacionando las figuras 6 y 10,
y 4 y 8.
Casi en el extremo del período , el O2, presenta una función de onda molecular
2px
Cuyas gráficas
, vendrían en las fig 11 y 12 para el OM antienlazante y 13 y 14 para
el enlazante
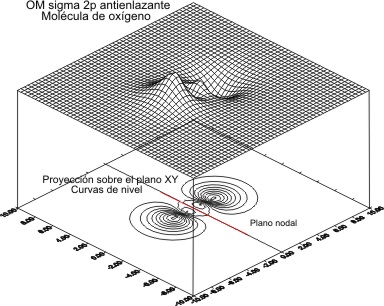
Fig.11
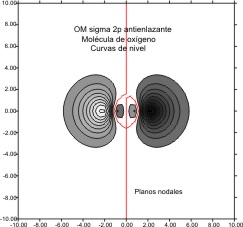
Fig.12
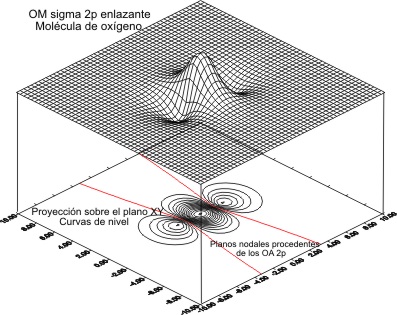
Fig.13
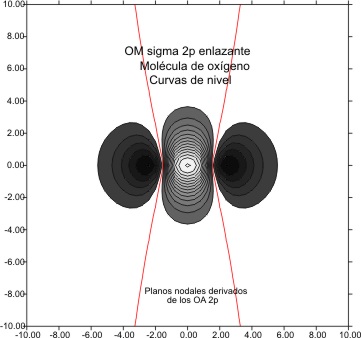
Fig.14
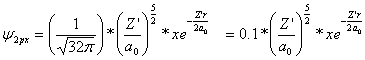 (1)
(1)