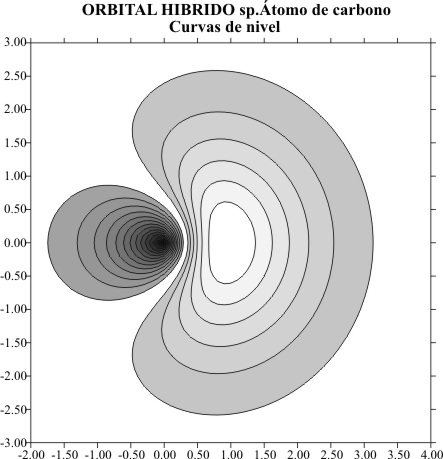
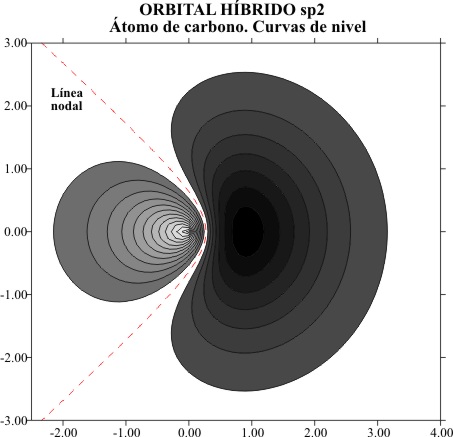
ORBITALES HIBRIDOS sp3
Para
terminar el tema de orbitales híbridos s y p, se tratará de los sp3.
Las funciones de onda que se combinarán en principio para formar cuatro orbitales
híbridos sp3 son la 2s, 2px , 2py
y 2pz en las siguientes combinaciones lineales:
![]() ;
;
![]() ;
;
![]() y
y
![]() (1)
(1)
Ahora bien, la función de onda 2s como se ha visto tiene por ecuación general:
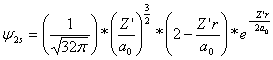 (2)
(2)
mientras que la
2px :
![]() ; la 2py
:
; la 2py
:
![]()
y la 2pz :
![]()
(3)
Sustituyendo 2, y 3 en
1, se obtendrán las funciones de onda de los orbitales híbridos a representar
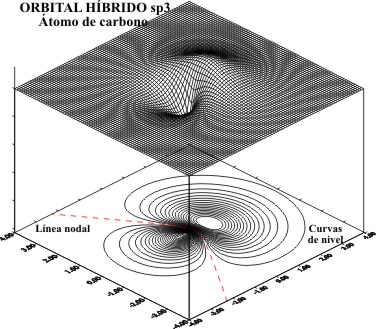
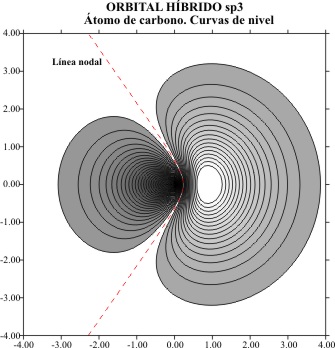
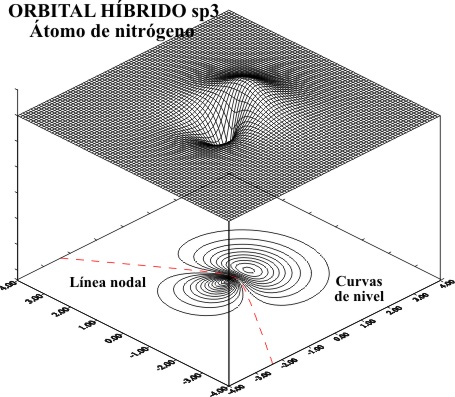
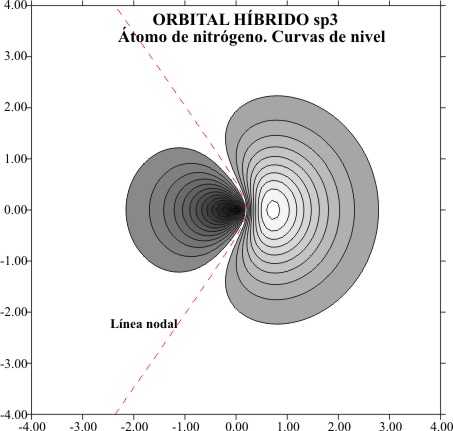
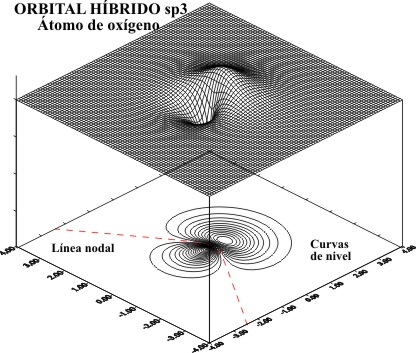
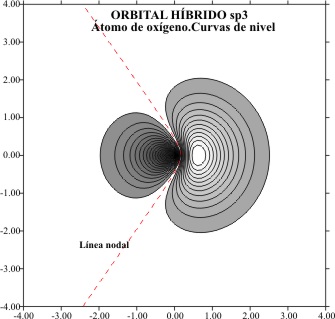
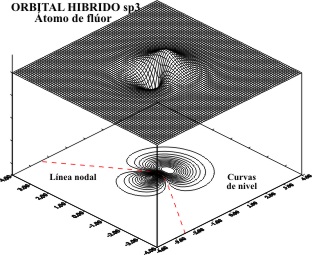
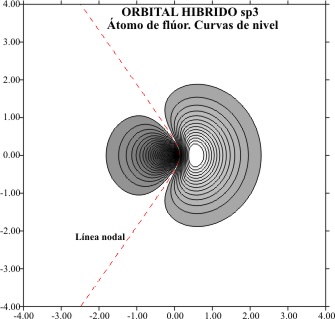
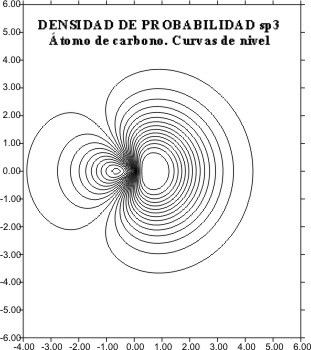
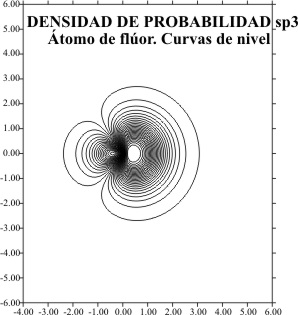
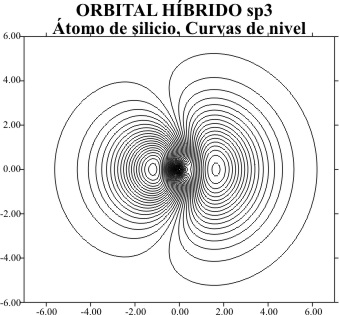
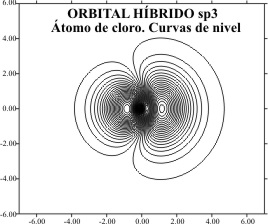
Como
en el tema anterior, se tomará para
el C, Z’=3,15. Para el N, Z’=3,8. Para
el O, Z’=4,45 y para el F, Z’=5,1
Como
se trata de comparar orbitales híbridos siempre se representará para cada átomo, la función
R1 de sus
orbitales híbridos sp3
La representación aplicando
el programa matemático de gráficas superficiales, tomando el eje z como x tal
como en temas anteriores, viene dada por las figuras 1 a 8