Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
DESDE EL COSMOS HASTA NUESTROS
SENTIDOS, LA CURIOSA HISTORIA DE UN ELEMENTO EXTRAÑO: EL BERILIO (Primera
parte)
Posiblemente cualquier persona
que admirase el rutilante aspecto de una esmeralda, o se endulzase, con
la debida precaución, su boca, con un poco del único sulfato que así lo
hace, pudiera relacionar ambas sucesos. Sin embargo, ambos los produce un
ión curiosísimo, de uno de los metales menos abundantes en el universo y
en la tierra, que en el hombre puede producir la muerte; el berilio.
Vamos a tratar de seguirle la pista,
analizando los factores que influyen en su viaje de 10 eones, hasta aquellos
que permiten detectarlo a nuestros sentidos.
El berilio, es un núcleo ligero,
con cuatro protones y cinco neutrones,
y por lo tanto con relación nuclear impar,
que debería producirse en los primeros momentos de la creación, a partir
de la propia formación del helio, por nucleosíntesis, tal como la mayoría
de los núcleos de los elementos químicos. Sin embargo es muy escaso en el
universo, frente a sus posibles progenitores. A partir de él se formaría
el oxígeno, que si, ya es abundante. )Por qué su escasez? Pues sencillamente, dado que no es un núcleo especialmente
estable, frente al de helio (4He2), a la temperatura
en que se formó se desintegraría, para encargarse de construir otros más
estables. Por este motivo, el berilio que llega a la tierra, es mucho más
joven que los demás constituyentes. )Quiénes son los padres de este
berilio que llegará a la Tierra?
Parece evidente que no puede producirse
por nucleosíntesis normal o fusión, como los elementos que lo rodean; la
energía desprendida en dichos procesos sería suficiente para volver a desintegrarlo.
Por lo tanto es necesario buscarle otra vía; esto es la reacción nuclear
ordinaria, de fisión. O sea, partiendo de núcleos mayores, de masa doble
y algo mayor, más estables y abundante, encontrar un "martillo"
capaz de romperlos en fragmentos más pequeños. Evidentemente, los más abundantes
son el oxígeno,(16O8), el nitrógeno (14N7),
y el carbono, (12C6), y el martillo necesario, las
partículas ligeras, como los protones integrados en rayos cósmicos primarios,
y por lo tanto con la energía suficiente para fracturar por ejemplo, al
nitrógeno.
La
reacción sería: 1H1 + 14N7
= 9Be4 + 4He2 + 2 (1H1).
Esta reacción ha sido recreada en aceleradores
de partículas, consiguiéndose efectos similares; por otra parte lo atestigua
la abundancia del berilio en los rayos cósmicos. La consecuencia es que
el berilio aparecerá aproximadamente cinco mil millones de años después
de la formación del universo a través de la explosión inicial.
El hecho anterior, y la constatación
a partir de los análisis de las sondas espaciales próximas a Júpiter de
la existencia de rayos cósmicos, compuestos por estos tipo de núcleos ligeros,
hace posible que precisamente en la etapa de formación de la Tierra, hayan
llegado como viajeros extraterrestres, introduciéndose en las redes de silicatos
de aluminio, debido a su pequeñisimo tamaño. Sin embargo al ser un huésped,
su abundancia es muy escasa; 5 partes por millón.
Evidentemente, el ion Be2+, tiene un radio de 0,3D o 3nm, lo que le permite colarse en estructuras mucho más separadas, invadiendo huecos y distorsionando las fuerzas eléctricas que originan los enlaces. Su densidad de carga es enorme, y por lo tanto su poder polarizante (debemos recordarlo). Su capacidad para sustituir a otros iones metálicos, pese a la diferencia de tamaño, es la clave de su aparición en dos piedras preciosas de distinto color; la esmeralda y el agua marina o berilo. La primera verde y la segunda azulverdosa, ambas con una cierta fluorescencia, que las hacen más valiosas. Por ellas ha habido guerras y crímenes. Pues bien, el que veamos a la primera verde, y a la segunda azul verdosa; de ahí su nombre, es responsabilidad indirecta del berilio como elemento químico.
Tanto una como otra, eran conocidas
desde la antigüedad. El nombre de esmeralda, como el de la mayoría de las
piedras preciosas no ha variado en el transcurso de miles de años, conservándose
los mismos usados por persas, hindúes y semitas, mientras que el berilo,
berilos de los griegos, será por
sus características el padre del término brillar.
En la Biblia se habla de él
[1]
y es signo de riqueza, opulencia y de dignidad,
por eso aparecen en las vestiduras de los Sumo Sacerdotes. A través de la
esmeralda, smeragda de griegos y árabes, desempeñó un papel histórico, en
función de su valor, estimulando la codicia de guerreros y gobernantes,
causando muchas veces su desgracia. Hernán Cortés la descubrió en Méjico,
y cuando las expuso en España, fue el principio de su declive. Hasta la
reina quiso quedarse con ellas.
Los primeros análisis químicos
de esmeraldas y agua marinas que realiza el sueco Tobarn Bergmann en la
segunda mitad del siglo XVIII, indican
una composición similar, pese al diferente color. En los análisis, siempre
surgía en mayor o menor proporción, la sílice, la alúmina y la cal. El profesor
berlinés Achard en 1779, repitió por seis veces el análisis, dando una composición
parecida, aunque el 5% de la materia desaparecía durante las operaciones.
Por otra parte, años después, lo analiza Bidheim, corroborando lo anterior
aunque con una pequeña proporción de óxidos de hierro, mientras que Klaproth,
hace lo propio con una esmeralda peruana, en la que no encuentra cal, y
una menor proporción de óxidos de hierro, por lo cual todo el mundo considerará
ambas piedras, de naturaleza diferente. Sin embargo el mineralogista Haüy
que había observado que las propiedades ópticas del BERILO y de la
esmeralda eran iguales
[2]
, incita a Vauquelin a repetir los análisis con
varios BERILOS. La comparación la damos en el cuadro:
| Científico |
Sílice |
Alúmina |
Óxidos de Fe |
Cal |
Glucinia |
| Berilo Achard (1779) |
60% |
22% |
5% |
8% |
|
| Berilo Bindheim (1785) |
64% |
27% |
2% |
8% |
|
| Esmeralda peruana Klaproth(1791) |
66% |
31% |
0,5% |
|
|
|
Berilo Vauquelin (1798) |
65% |
14% |
Óxido de Cr 4% |
2,6% |
13% |
De esta forma, Vauquelin, dando estos resultados, comunicará el 14 de febrero de 1798, en la Academia de Ciencias francesa, bajo el título "Sobre el agua marina o berilo, y sobre el descubrimiento de una tierra nueva en este mineral", el descubrimiento de una nueva sustancia (un óxido) cuyas sales tenían un cierto sabor dulce, por lo que la llamó GLUCINIA derivado del griego GLYCOS (γλυχύς, dulce).
Por eso, el elemento que la formaba,
sería el GLUCINIUM y su primer símbolo G, pasando a ser en los primeros
sistemas periódicos Gl, que es como se conoció en todos los textos de Química
del siglo XIX. Es realmente curioso que sea único elemento cuyo símbolo
haya durado 100 años en los textos químicos, para ser posteriormente cambiado.
Así apareció en el primer sistema periódico
de Mendeleev, de 1867. Ese mismo año, Gmelín también encuentra dicho
metal en unos berilos rusos, extraídos de las minas de Nerchinsk.
Klaproth que estaba por aquellas
fechas, enemistado con Vauquelin, y puesto que no sólamente era patrimonio
de dicho elemento el sabor dulce, que también aparecía en algunos otros
compuestos, como el acetato de plomo (azúcar de plomo) y las sales de la
Ytria, lo rebautiza con el nombre de BERILIUM procedente de la TIERRA
DE LA BERILIA, nombre que se impondrá y que modificará su símbolo hasta
Be
[3]
.
Ahora que ya conocemos la composición
de esmeraldas y berilos
)Dónde están los centros de color,
y en qué radican las propiedades ópticas que los hacen tan valiosos, y
apreciados así por nuestros sentidos?
El problema de la esmeralda y del
aguamarina, la primera verde y la segunda azulverdosa, con estructuras geométricas
similares, y composición casi idéntica; son silicatos de aluminio y berilio,
pero de diferente color, lo cual las hacía piedras diferentes, se debe a
la diferente proporción de cromo y hierro. El elemento responsable directo
del color en la esmeralda es el cromo, en forma de ión Cr3+, mientras que en el berilo o
agua marina, es el Fe3+.
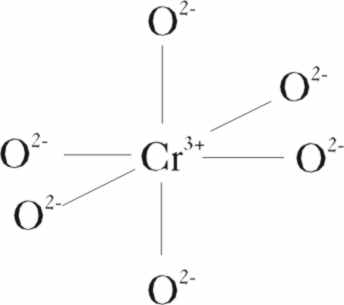
El ión
cromo 3+, tiene una estructura electrónica externa 3d3,
con los electrones desaparejados en los orbitales 5d, que en una coordinación
octaédrica con 6 O2- (fig.1), desdobla muy poco sus niveles energéticos,
en el campo débil del ión oxígeno de tal forma que absorben en el visible,
como se explicó al hablar del cromo. En este caso trataremos de justificarlo
en la teoría espectroscópica de un campo cristalino, ya que no se trata de
iones en disolución, sino de iones inmersos en una determinada estructura
cristalina.
La distancia de enlace Cr-O, es de 1,9D, y su carácter iónico es del 63%.Esto es importante
para justificar hasta que punto los pares electrónicos están más próximos
o no al metal o al oxígeno.
El estado fundamental del cromo 3+,
con los 3 electrones desaparejados
en los orbitales d, siguiendo las leyes
de Hund, presenta una multiplicidad (2S+1), siendo S la suma de los espines
2.(3.1/2)+ 1 = 4, (fig.2) y puesto
que la suma de los números cuánticos m o sea L es 3, el nivel
base de menor energía será el 4F, y el estado fundamental 4A2g,
los estados excitados, con energías que entran en el espectro visible son
el 2E, 4T1 y 4T2.
Si tomamos los diagramas energéticos propuestos
para dicho estado por los japoneses Tanabe y Sugano, adaptados al caso de este ión,
observaremos que las energías de
tránsito para dichos estados 4T1 y 4T2, varían notablemente
por la acción del campo eléctrico (en abscisas) de los iones vecinos (fig.3)

Fig.1
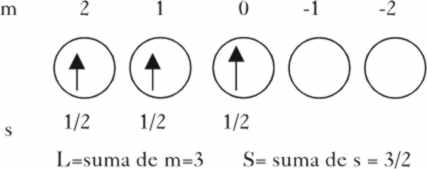
Fig.2
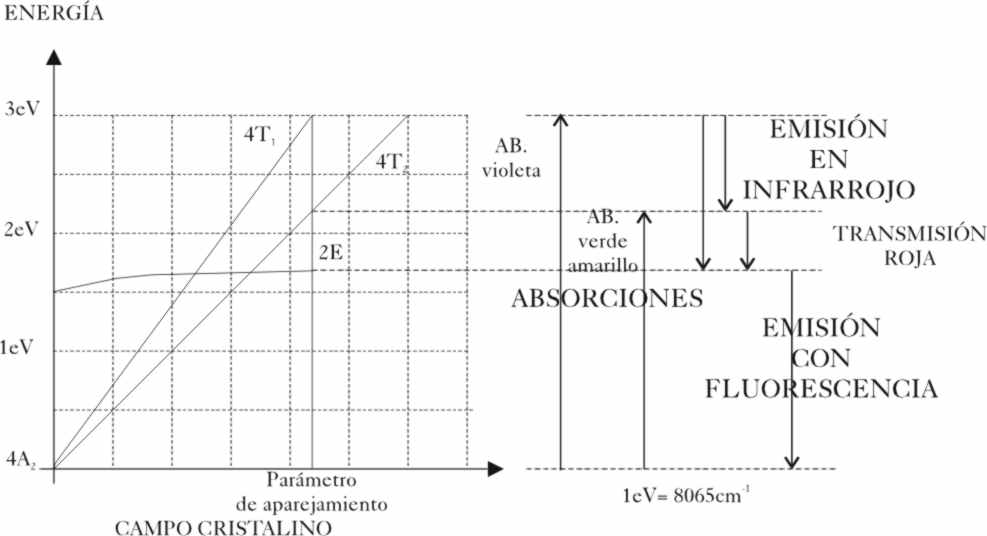
Fig.3
Hemos dicho que el oxígeno O2-,
produce un campo débil porque debido a su gran electronegatividad, no tiende
a dar o ceder sus electrones, lo que produce un complejo de alto
espín (electrones lo más desapareados). Si observamos la gráfica, veremos
que los tránsitos implicarían una absorción
de energía, si se produce desde el nivel fundamental hasta el 4T1,
en el violeta, mientras que si ocurre al 4T2, sería en el verde
y amarillo. Si a la luz blanca se le priva de la componente violeta, verde
y amarilla, aparece con un color rojizo. Por eso si sólo fuera cuestión
del cromo3+ y del oxígeno 2-, el cristal tendría ese
color, característico por ejemplo del rubí , tal comose aprecia en la fig.3
Fig.4
En el agua marina, la impureza de Fe3+,
y el ión Be2+ son los responsables del color.
El ión Fe 3+, en un campo de bajo
espín debido como siempre al papel del O 2-, tiene sus cinco electrones
3d5, dispuestos en los cinco
orbitales d, prácticamente sin desdoblar en un estado fundamental (fig.5).
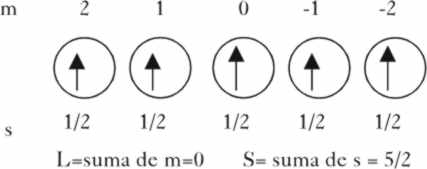
Fig.5
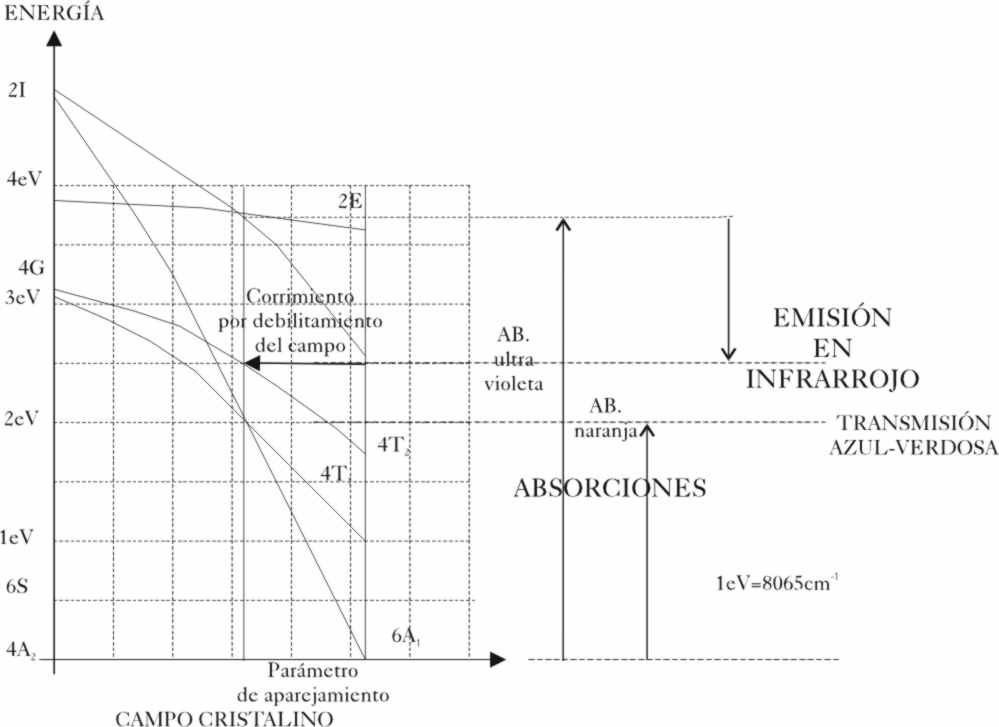
Fig.6
Hemos visto que debido a la acción del berilio, la emisión energética
de la esmeralda o del agua marina, produce unos fotones con una frecuencia
tal que captada por nuestros ojos, hacen que nuestro cerebro lo interprete
como verde o azul. )Cuál es el camino seguido por la emisión energética, para que nuestro
cerebro lo traduzca así?.
[1]
Surge, en las profecías de Ezequiel
28,13, cuando habla de las riquezas del paraíso. En ella diferencia el
beryllus de la smaragdus. También aparece en la Apocalipsis de San Juan,
21. En la referencia a las doce piedras que adornaban los muros de la
ciudad celestial; la cuarta era la smeragdus, mientras que la octava era
el beryllus.
[2]
Plinio ya deja
constancia del parecido entre el berilo y la esperalda en su historia
natural, libro 37, pero será Fourcroy, gran amigo del mineralogista Haüy
y protector y maestro de Vauquelin, el que explique su contribución al
descubrimiento: "Es a la geometría a la que debemos, la causa
del descubrimiento...ya que después del análisis que hizo M.Klaprot de
la esmeralda y M.Bindheim del berilo, no habría que pensar en la posibilidad
de que esta tarea comenzara otra vez, de no haber sido por las grandes
analogías o hasta la casi completa
identidad, que el ciudadano Haüy encontró en las propiedades geométricas
es estos dos fósiles pétreos".
[3]
En la mayoría de los textos
aparece Wöhler, como el bautizador del elemento, 30 años después. Debe recordarse que
los elementos toman el nombre de la tierra de la que fueron extraidos,
y al determinar Klaproth el de berilia, implícitamente se lo daban al
elemento aunque no lo hubieran aislado puro.