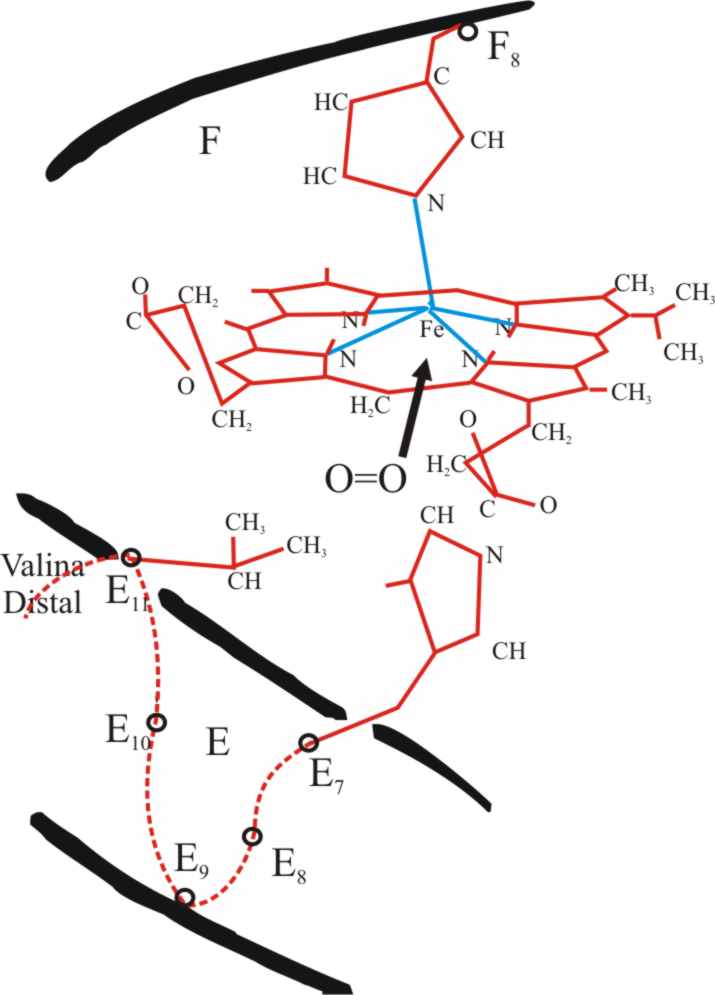
Fig.17
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Vamos a ver cómo responde y cómo
se transforma el hierro desde el punto de vista atómico y molecular, en la
función vital de la respiración. El oxígeno alojado en los capilares pulmonares
se encuentra con el hemo de la hemoglobina, pero sólo puede aproximarse en
una orientación normal por debajo del plano del hemo buscando un hueco que
debería dejar la sexta posición de coordinación, aunque aparte de la histidina
distal, la cadena lateral de una valina (aminoácido 62 en la cadena α
y 63 en la β), ejercen un notable impedimento estérico (fig.17). Pese
a ello y a la gran densidad electrónica del oxígeno, consigue hacerlo, produciendo
una acción más intensa sobre los orbitales d del hierro que la que ejercían
los pares no ligantes del nitrógeno de los ciclos aromáticos del pirrol y
de la histidina. Este hecho va a disparar un mecanismo atómico fascinante,
con una sucesión de fenómenos en cadena.
La aproximación del oxígeno por
debajo, con su gran densidad electrónica provoca un desdoblamiento energético
mayor en los orbitales atómicos d del ión ferroso (fig.18).
ASPECTOS
ATÓMICOS DEL HIERRO EN LA VIDA DEL HOMBRE (Continuación)
El hierro y la respiración

Fig.17
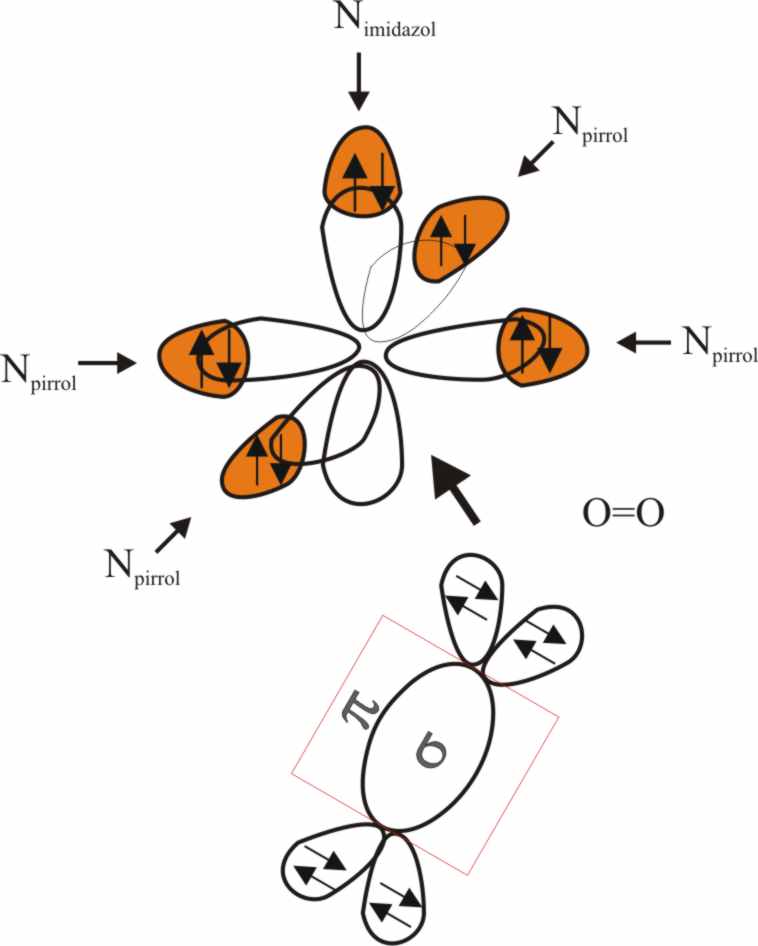
Fig.18
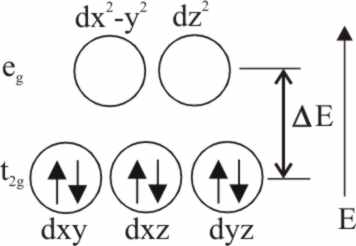
Fig.19
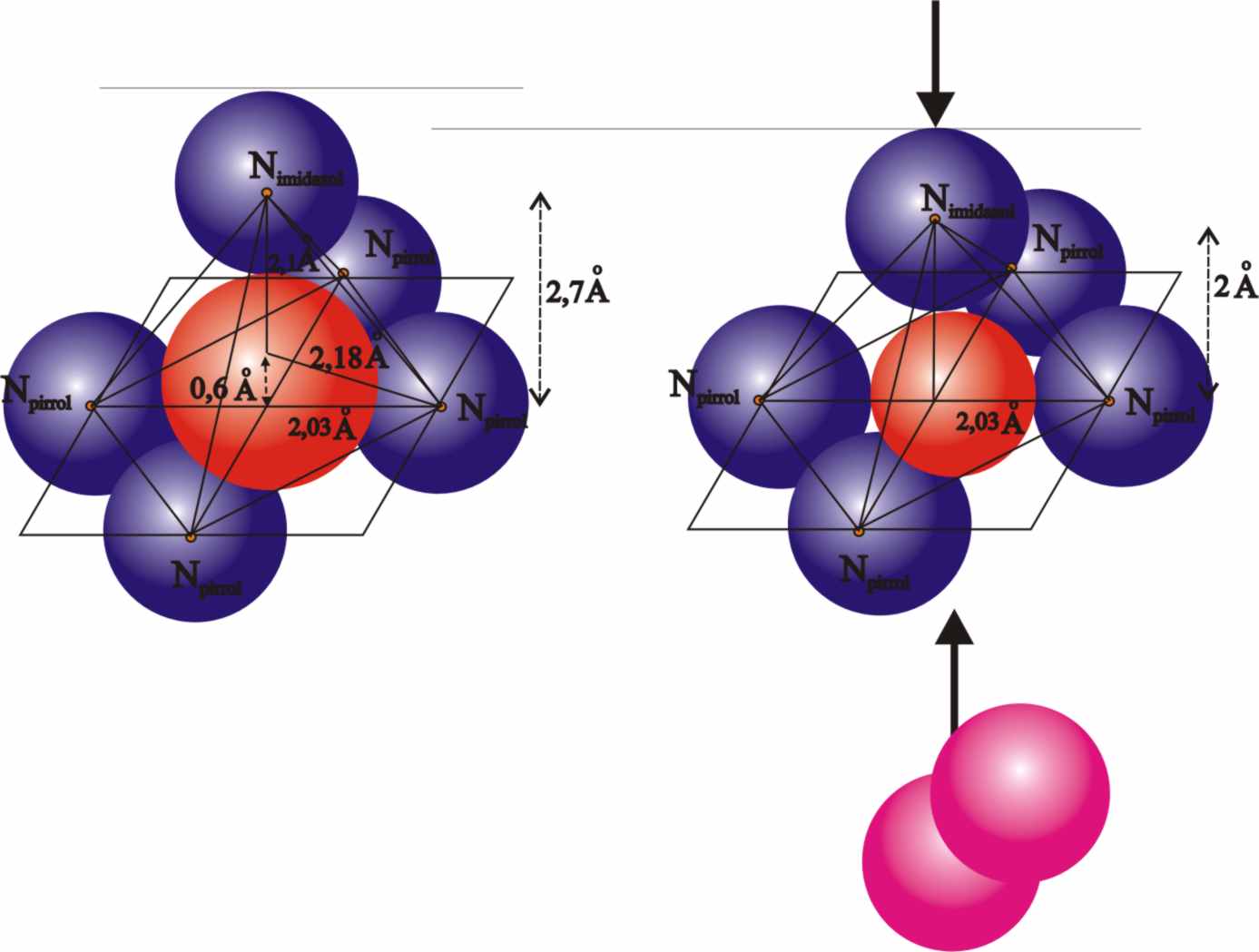
Fig.20
Fig.21
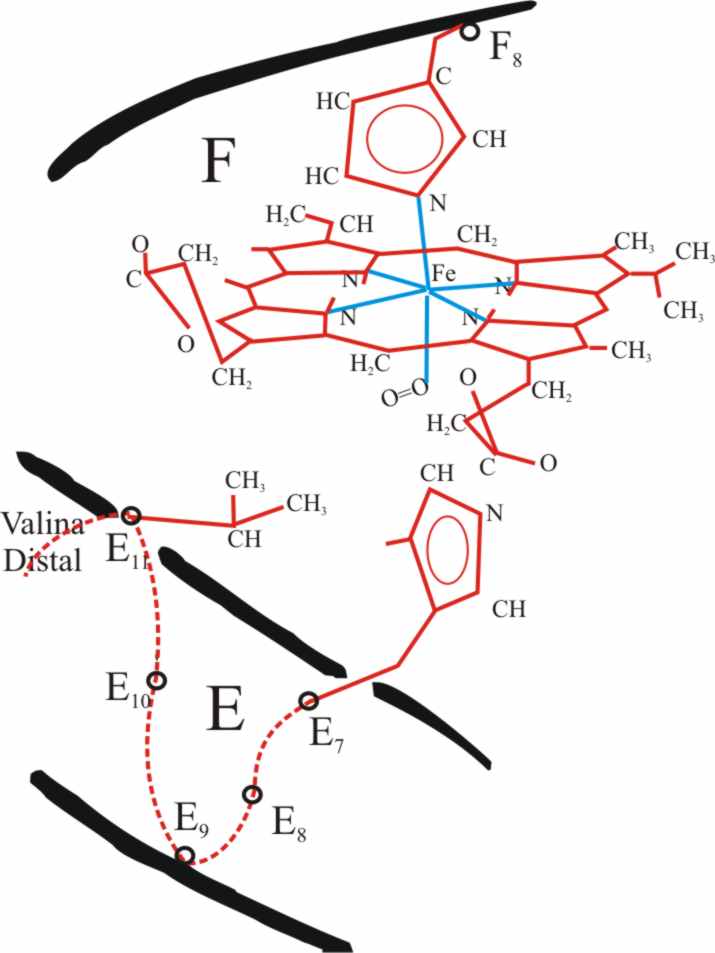
Fig.22
Vamos a explicar la adecuación
interna del ión ferroso, para realizar su papel fundamental en la vida.
Los orbitales atómicos del Fe2+
con la simetría adecuada para superponer con los orbitales atómicos de los
ligados (GOL), y formar así los OM enlazantes y antienlazantes por combinación lineal (CLOA), son el d(x2-y2)
y d(z2), además de los 4p (x,y,z) y el 4s.
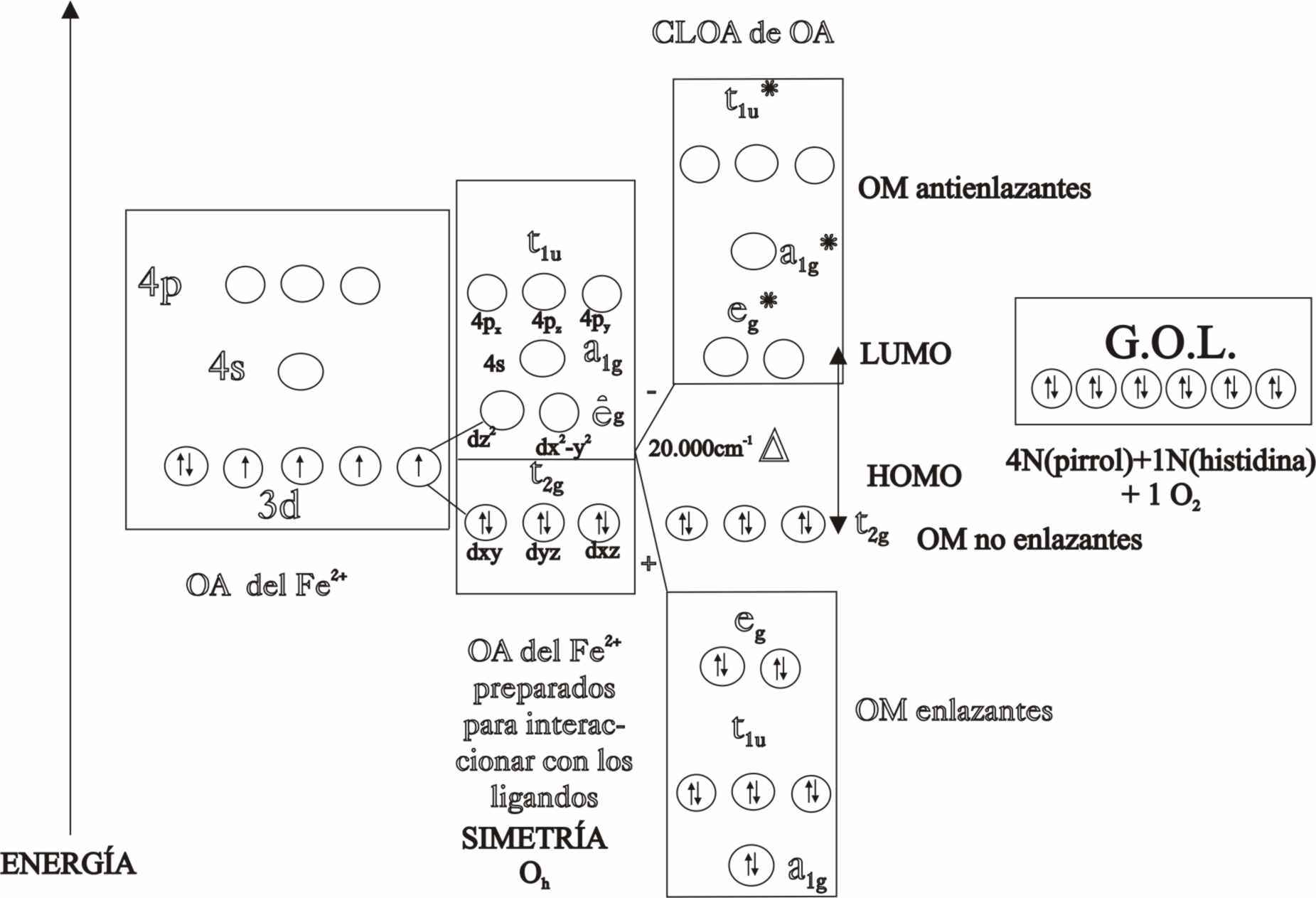
Fig.23
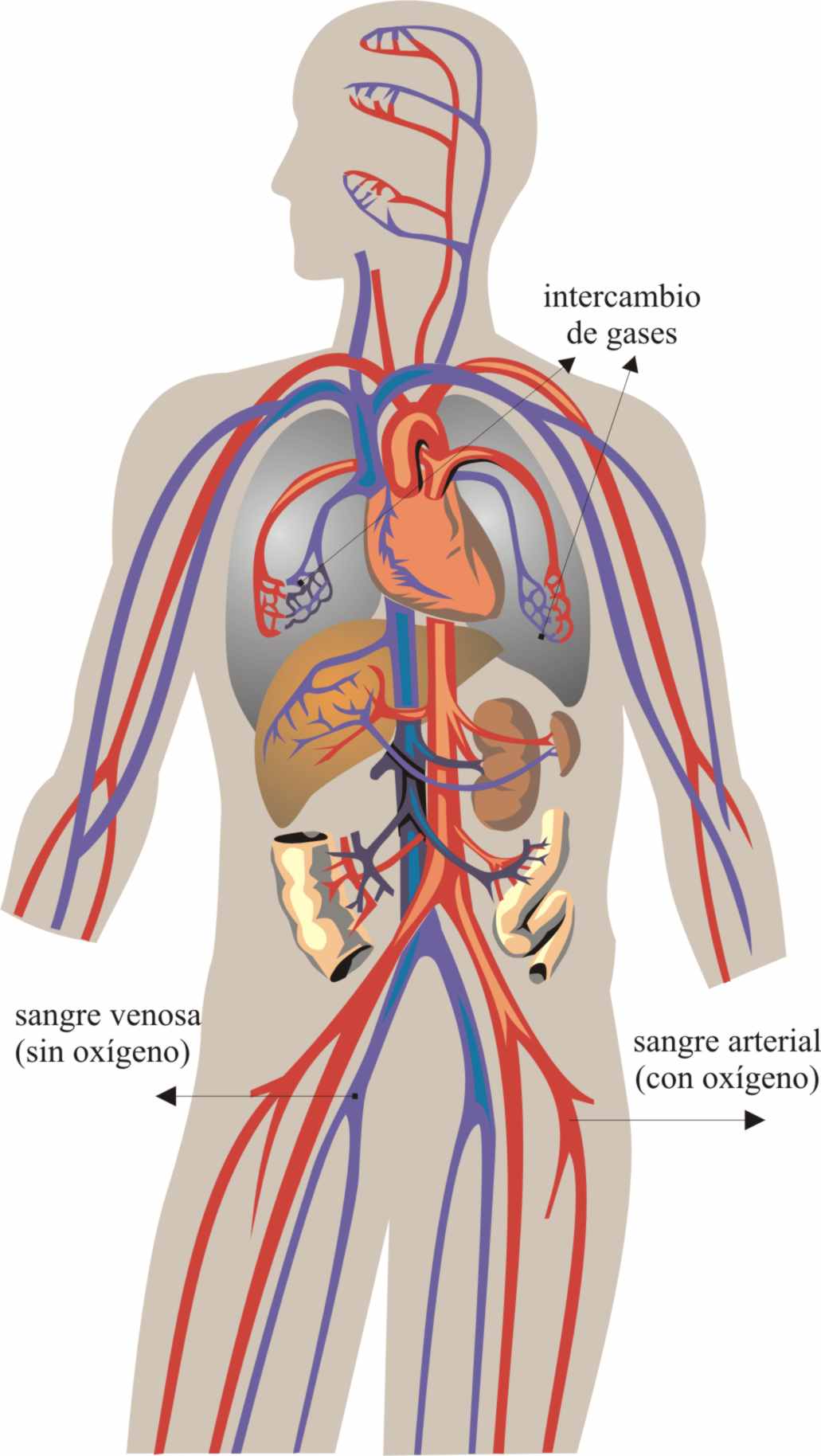
Fig.24
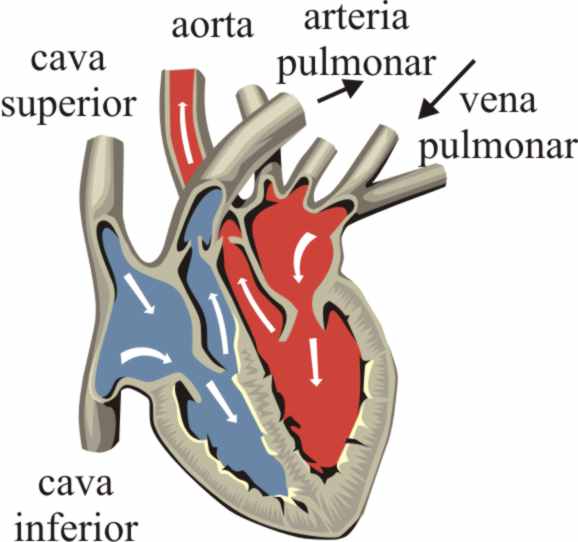
Fig.25(detalle)
Realmente en el desarrollo de la
TOM (teoría de orbitales moleculares), aplicada al campo de ligandos del complejo
hemo-oxígeno, necesario para explicar el papel del hierro como elemento fundamental
en la vida, hemos simplificado diversas interacciones e interpretaciones,
pues sólo se han considerado las interacciones σ. También se producen interacciones π, que
suelen aumentar la energía de desdoblamiento aunque en este caso, debido a
la gran electronegatividad del oxígeno, la retrodonación electrónica se produciría
a la inversa.
Si partimos de la desoxihemoglobina,
en la que el ión ferroso forma un complejo con estructura piramidal con los
cuatro nitrógenos pirrólicos, y el cierre con el nitrógeno de la histidina
proximal, y teniendo en cuenta como hemos dicho que la histidina distal le
abre la puerta por la parte inferior a la molécula de oxígeno, podríamos considerar
que ésta realmente organiza una interacción en forma de aducto, mucho más
fácil de liberar en los diferentes tejidos, como se deja entrever en la fig.24;
la sangre con oxihemoglobina (roja), en los diferentes tejidos, deja el oxígeno,
convirtiéndose en sangre con desoxihemoglobina (azul)
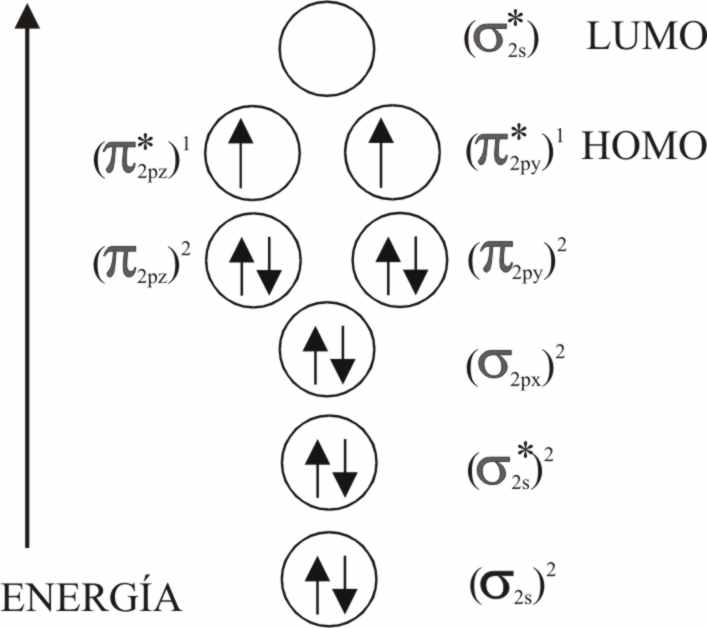
Fig.26
Para ello hemos de tener en cuenta
que la molécula de oxígeno presenta una estructura por OM, en la cual los
doce electrones externos (n=2) se distribuyen por orden energética en los
diferentes OM, de forma que el π2p enlazante se completará
con cuatro electrones, mientras que el π2p antienlazante se
semillenará siguiendo la ley de Hund, siendo el HOMO de dicha molécula responsable
de su acentuado paramagnetismo (fig.26).
Ahora bien, al acercarse la molécula
de oxígeno al complejo piramidal sus propios OM se desdoblarán, puesto que
sólo el πpz puede por simetría deslocalizar sus electrones
en el d(z2) del Fe2+.
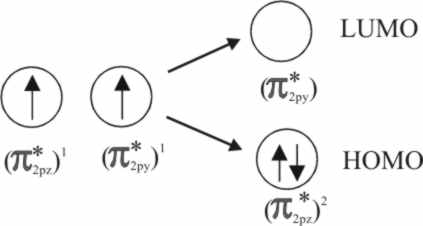
Fig.27
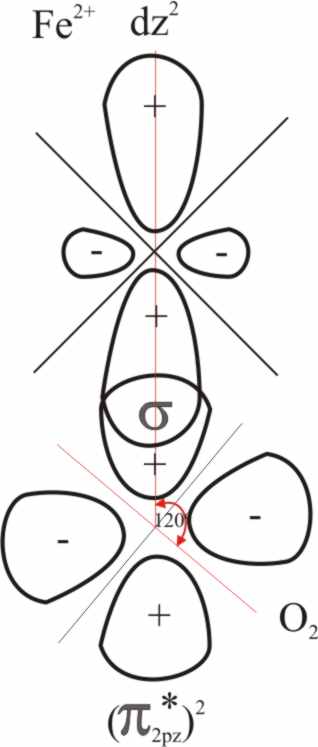
Fig.28
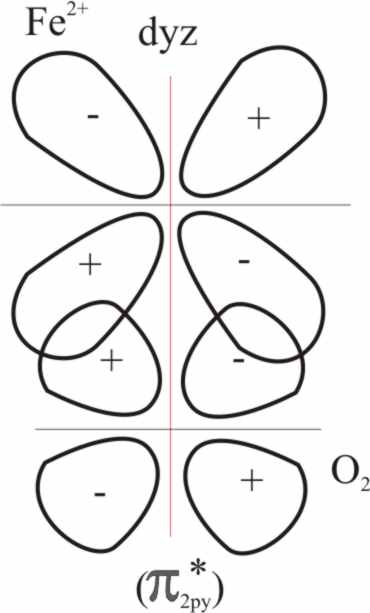
Fig.29
Esta especie de retrodonación va
a estabilizar los electrones del metal, antes no enlazantes produciendo por
CLOA dos nuevos orbitales moleculares: π(d(yz +/- π py).
De esta forma una vez distribuidos los pares de electrones "normales"
de los ligandos, o sea los que poseen simetría sigma en los OME de menor energía,
la "zona conflictiva" estará constituida por los nuevos orbitales
moleculares que se han formado por combinación lineal de los ya descritos,
zona que se encargará de acomodar a los seis electrones del Fe2+
y a los dos electrones π antienlazantes del O2 (fig.30).
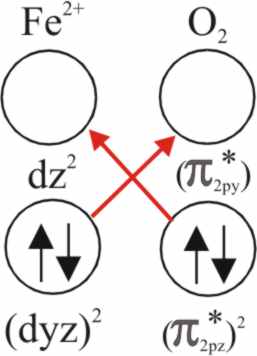
Fig.30
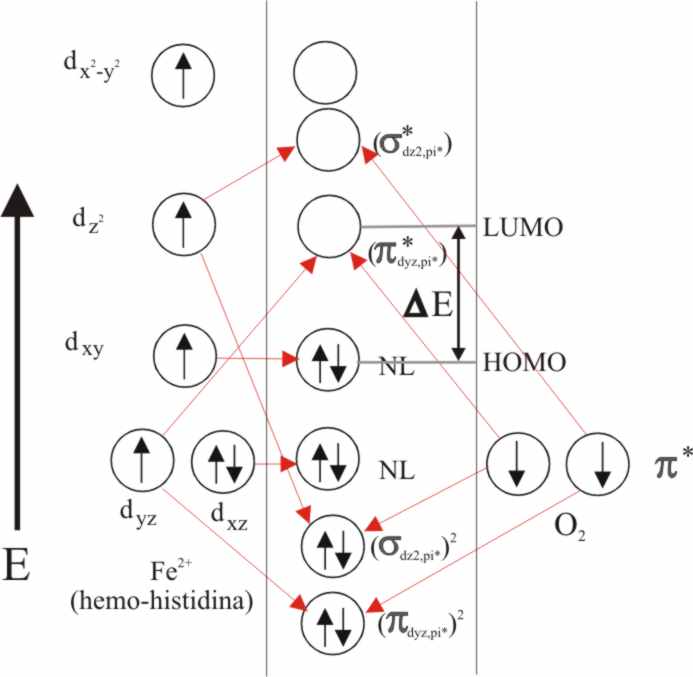
Fig.31
Así el nuevo HOMO del complejo
será un d(xy), que ya no integrará el grupo t2g, mientras que
el LUMO vacío será el π* (antienlazante) formado en el CLOA d(yz)-π(py).
Como se puede observar la energía
de separación entre el HOMO y el LUMO, ha disminuido bastante respecto al tratamiento anterior lo cual está de acuerdo
con los hechos experimentales, afinando mucho más las características de
la absorción
[3]
(fig.31).

Fig.32
1 El nombre de pirrol, propuesto por Runge en
1834, deriva del griego πϋρ, fuego, y del latín oleum,
aceite, en el sentido de aceite
obtenido por el fuego, ya que se obtuvo por destilación de huesos
[2]
No toda la sangre que circula
por arterias es oxigenada, ya que
la arteria pulmonar que lleva la sangre del ventrículo derecho a los pulmones,
transporta sangre sin oxígeno, mientras que la vena pulmonar, que lleva
la sangre a la aurícula izquierda, transporta
la oxihemoglobina (fig 25).
[3]
La energía de enlace Fe2+-O2, experimental en la hemoglobina es de -65,3 kJ.mol-1, por mol de oxígeno
absorbido.
[4]
Este cierre de puertas, impide la entrada y posterior
intercambio, del monóxido de carbono que se puede producir en la actividad
metabólica normal.