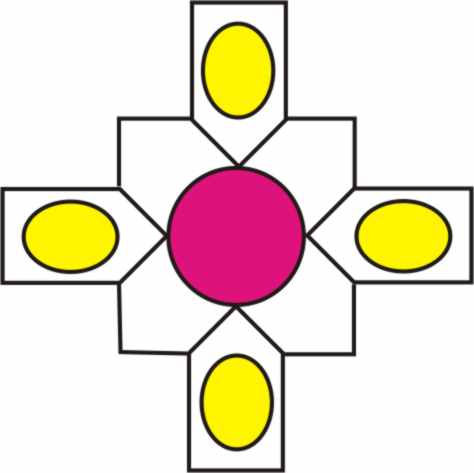
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
BIOINORGÁNICA
DEL HIERRO EN EL SER HUMANO
El hierro y su estructura en el organismo
humano (Primera parte)
El hierro, un metal fundamental,
el más abundante en el universo, en el sistema solar y en la Tierra y en el
hombre, fue considerado ya desde las primeras civilizaciones como algo llegado
del cielo y enviado por los dioses. Por
ese motivo (procedencia meteórica), fue llamado Ku-au, Parzilu y Barzel por
sumerios, asirios y hebreos. En el segundo milenio antes de Cristo sustituirá
al bronce en su utilización como elemento bélico causante de muerte y metal
por excelencia, símbolo de la dureza, de ahí que también lo reemplazara en
su denominación. Así de ar y aurum del oro, pasará a aer, cobre, bronce, con
raíz indoeuropea hasta el iarum, iren e isarno, nombres del hierro en gaélico,
viejo inglés y celta respectivamente, precursores
de sus denominaciones actuales.
Pues bien, este elemento, venido
inicialmente del cielo, sentenciador de guerras y productor de muertes, también
será responsable de la vida del hombre, incorporado en su fluido vital: la
sangre.

Fig.1
Perutz, Nobel de Química de 1962
por sus trabajos en la estructura de la hemoglobina
[1]
, tilda al hierro de "joya en el centro de una corona".
Pues bien, esta corona va a presidir una función
tan importante como dar energía a la maquinaria humana aportando el oxígeno
necesario para la combustión de sus alimentos. )Cómo se incrusta la joya, y qué
forma tiene la corona?
El hierro elemento con 26 electrones
dispuestos en sus respectivos orbitales atómicos, va a perder sus electrones
externos 4s, para poder engarzarse, encontrándose en un estado de oxidación
2+, y se va a unir a través de un enlace coordinado a un macroanillo
formado por los ocho eslabones que
integran su corona (fig.1). Ese macroanillo denominado porfirina por su color
[2]
está formado de cuatro piezas cíclicas de cuatro carbonos y un nitrógeno,
llamadas pirrol, unidas entre sí por puentes alquílicos de un carbono o metilenos
(fig.2).
La corona y la joya que sólo se
insertará en aquella cuando cumple su función vital, reciben el nombre de
grupo hemo
[3]
.
Vamos a estudiar las uniones que fijan la joya a la corona o en términos
más exactos, el hierro a la proteína, para comprender mejor la función que
va a desempeñar.
El ión ferroso, aparte de coordinarse con los nitrógenos de los anillos
pirrólicos que forman la porfirina o mejor protoporfirina X, sufre la interacción
de un quinto punto de unión (como el seguro de engarce de la joya), que lo
ancla en la proteína encargándose de protegerlo. Este quinto ligando está
constituido por un nitrógeno de un anillo imidazol (pentagonal, con tres carbonos
y dos nitrógenos), procedentes del aminoácido histidina, que se sitúa a 2,7Å del plano del macroanillo.
Ahora bien, los cinco ligandos aunque procedan de nitrógenos de anillos aromáticos
no ejercen la misma perturbación sobre los electrones más externos del Fe2+,
puesto que tampoco tienen igual deslocalización dado que el anillo del imidazol
es diferente que el del pirrol (fig.3)
El orbital atómico que más sufre
dicha interacción según su disposición espacial, será el d(x2-y2),
por estar dirigidos sus lóbulos en el sentido de aproximación de los pares
electrónicos no enlazantes del nitrógeno de los pirroles, en el momento de
la coordinación. Ahora bien, esta distorsión es pequeña debido al carácter
duro de la base pirrol
[4]
, al estar estabilizados en la nube π aromática
del anillo.
El otro orbital perturbado será
el d(z2) (fig.4 y 5), por
la acción en un único sentido del par electrónico del nitrógeno del imidazol.
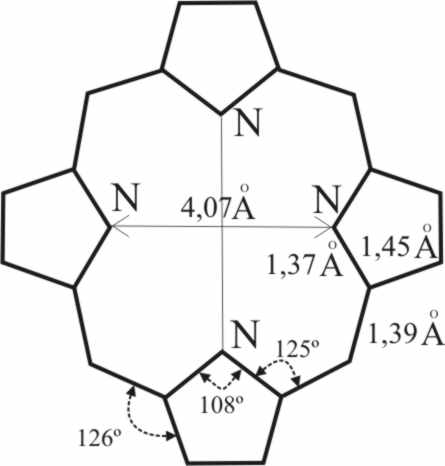
Fig.2
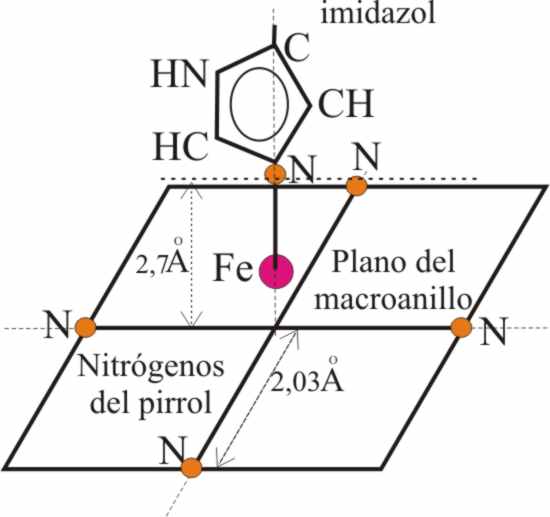
Fig.3
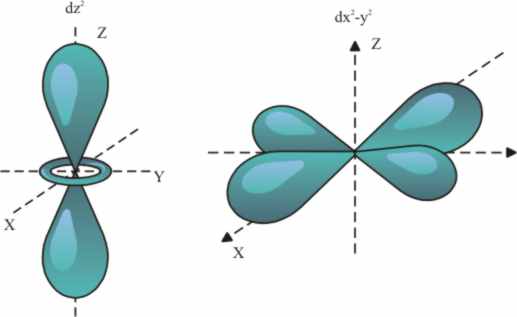
Fig.4
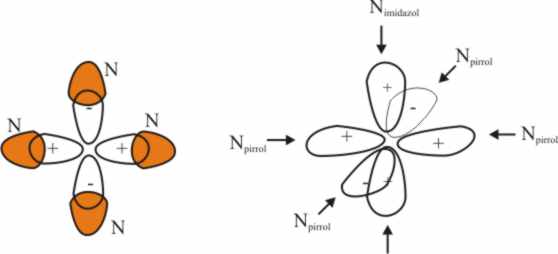
Fig.5
En una estructura de pirámide tetragonal,
con los ejes convenientemente dispuestos, sólo no sufrirán la acción electrónica
aquellos orbitales del hierro dirigidos según las bisectrices de los ejes
de coordenadas, esto es el d(xy) (con simetría b2)
[5]
, y los d(xz) y d(yz), ambos con simetría e1.
Ahora bien, debido a la escasa
perturbación, no se va a producir el desdoblamiento energético suficiente
y los seis electrones d del hierro rellenarán los cinco orbitales d, siguiendo
la ley de Hund, esto es, provocando un máximo desparejamiento y un momento
magnético elevado. Debido a ello, estos complejos se denominan de alto espín.
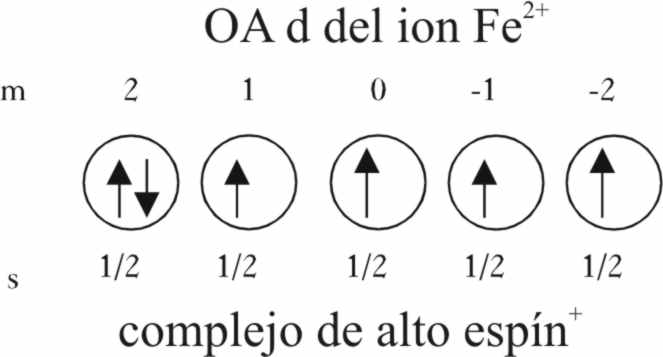
Fig.6
Una vez dispuestos cinco orbitales
de idéntica simetría del Fe2+ (joya) y de los correspondientes
del N del pirrol e histidina, el CLOA (combinación lineal de orbitales
atómicos para formar los orbitales moleculares OM), implica la producción
de diez OM, cinco enlazantes de menor energía y otros cinco antienlazante
de mayor energía. Podemos detallarla así:
(e1) = 4px
y 4py (a1) = 4s y 3d(z2) (a1) = 4pz
Las combinaciones lineales correspondientes producirán:
φ(e1) +/- 2φ(GOL) = φOM (e enlazante) y φOM(e)*
[6]
. * = antienlazante
φ(a1) +/- φ(GOL,a1) = 3φ(OM) = φOM(a1) enlazante, φOM(a1) no enlazante(OMNE), y φOM(a1)*
φ(a1) +/- φ(GOL, a1) = 2φ(OM) = φOM a1
y φOMa1* .
Los otros tres OA del ión ferroso,
engendrarán OM no enlazantes por no poder "cloar". De esta manera
una vez determinados y ordenados de menor a mayor energía, los diferentes
OM, procederemos a alojar los electrones siguiendo el principio de aufbau.
Primero los cinco pares de los ligandos en los a1, e1,
b1 y a1, todos ellos enlazantes. Después los seis
electrones d del ión ferroso, rellenarán los OMNE (orbitales moleculares
no enlazantes) e1 (procedentes del
d(xz) y d(yz)) y el b2 (procedente del d(xy). El último
de los no enlazantes, derivado del CLOA, será el HOMO (orbital molecular
ocupado de mayor energía) del complejo, mientras que el primer antienlazante
de menor energía, que no ha llegado a cubrirse en el relleno electrónico
será el LUMO (orbital molecular desocupado de menor energía) de dicho complejo
(fig.7)
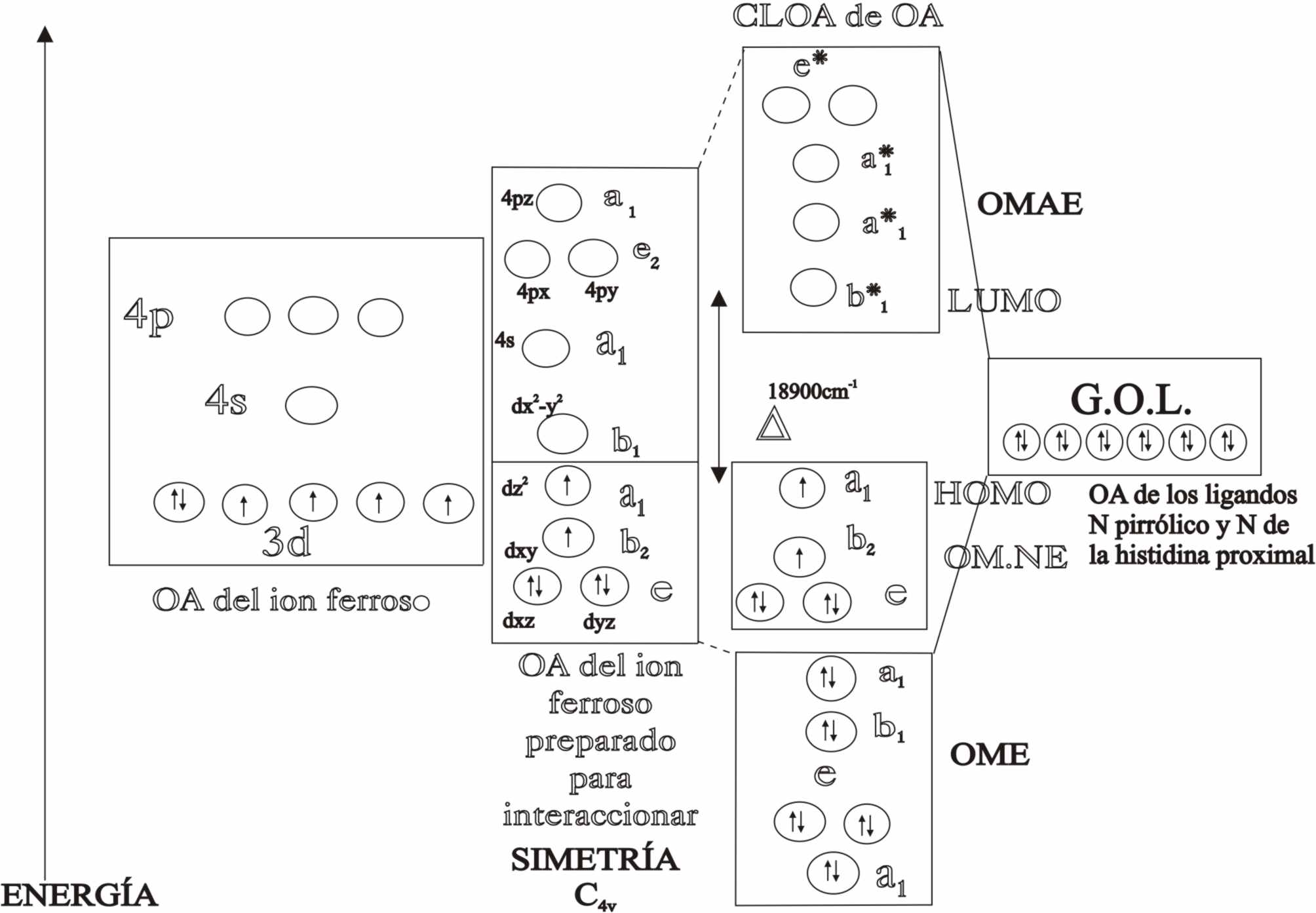
Fig.7
El tránsito entre HOMO y LUMO con
la absorción de la energía correspondiente por parte de los electrones implicados,
será responsable del espectro de
complejo y justificante de su color púrpura.
La energía de desdoblamiento entre HOMO y LUMO, Δ corresponde a un número de onda de 18.900cm-1, con absorción de luz en una longitud de onda de 5300Å o 530nm, con espectro de color verdoso, en consecuencia y según el cuadro siguiente (fig.8), la emisión se hará en el púrpura.
)Cómo queda engarzada y dispuesta
en la corona nuestra joya fundamental de la vida?
Ya hemos dicho que la disposición
geométrica de los orbitales s, p y d del metal con los 5 de los ligandos,
va a producir ya por distorsión de la estructura octaédrica (efecto Jahn Teller)
ya directamente como pirámide tetragonal. La molécula por otra parte será
paramagnética, al tener electrones desapareados, formándose lo que se llama
un complejo de alto espín.
El ión ferroso, al emplear en los
enlaces, OA 4s y 4p, tendrá un radio superior a lo normal (0,78Å), por lo
cual no cabe en el centro de la corona porfirínica.
La distancia de enlace Fe-N con
los pirroles (soldadura normal con la corona) es de 2,18Å, pero como el hueco
que le dejan los nitrógenos del macroanillo es de 2 a 2,05Å, el Fe2+
se ve obligado a situarse por encima del plano del anillo, aproximadamente
unos 0,6 a 0,8Å. Al mismo tiempo, el nitrógeno del imidazol (seguro de engarce
de la joya), se traslada a 2,7Å de la base cuadrangular y por eso a 2Å aproximadamente
del ión ferroso (fig.3, 9 y 10).
Esta estructura mantiene prácticamente
la joya suspendida, con soldaduras muy débiles (enlaces coordinados),
que necesitan protegerse. Ahora estudiaremos cómo se inserta la corona, y
cómo es el seguro de enganche (fig.11).
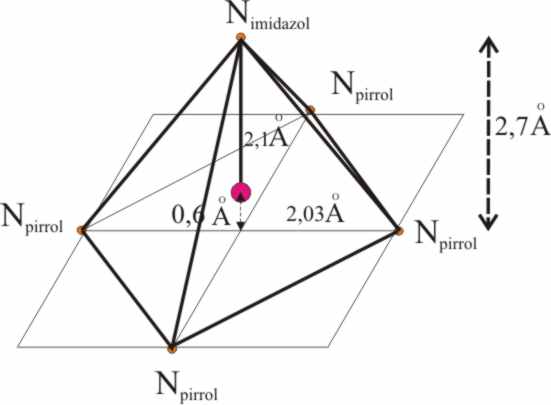
Fig.9
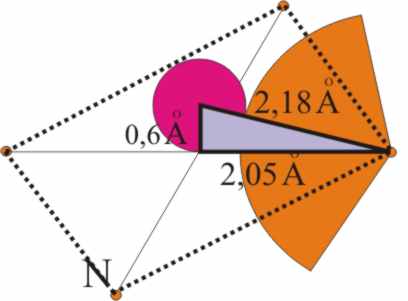
Fig.10
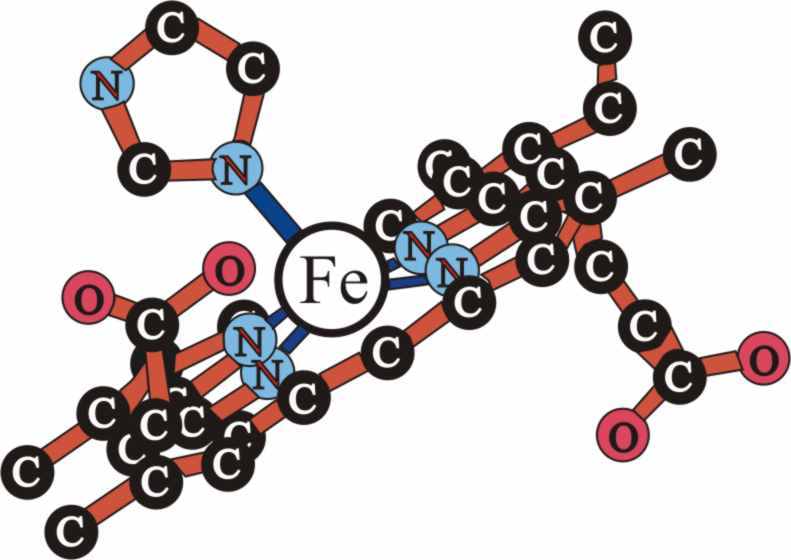
Fig.11
La corona con su joya, se encuentra
enganchada por el seguro, dentro de una oquedad formada por el plegado de
la cadena proteínica, ya en la mioglobina que transportará el oxígeno al tejido
muscular, ya en las hemoglobinas α y β, esta última muy parecida
a la mioglobina, que lo hacen en el plasma sanguíneo. Esta oquedad está adaptada
de tal forma que va a proteger al Fe2+, nuestra joya, de una posible
oxidación a Fe3+, que no cumpliría la función transportadora del
oxígeno. )Cómo la protege?
Sencillamente creando una atmósfera
apolar, dirigiendo todas las ramificaciones alquílicas, hacia la joya. De
esa forma el medio que rodea al Fe2+ tiene un coeficiente dieléctrico
ε muy bajo, y como la fuerza eléctrica regida por la ley de Coulomb
[7]
, es inversamente proporcional a dicho coeficiente,
será lo suficientemente grande para evitar la separación de un electrón, necesaria
para la formación del Fe3+.
Al mismo tiempo los grupos propiónicos
se dirigen hacia afuera impidiendo con su volumen, la aproximación de moléculas
más grandes que pudieran deformar la cavidad.
En la mioglobina el plegado conforma
8 regiones: A, B, C, D, E, F, G y H, de aminoácidos en hélice dextrógira y
otros cinco segmentos intermedios: AB, CD, EF, FG y GH en los cuales las secuencias
de aminoácidos forman líneas quebradas. Después existe una región de cabeza
N y otra de cola HC (fig.12).En total lo integran 151 aminoácidos.
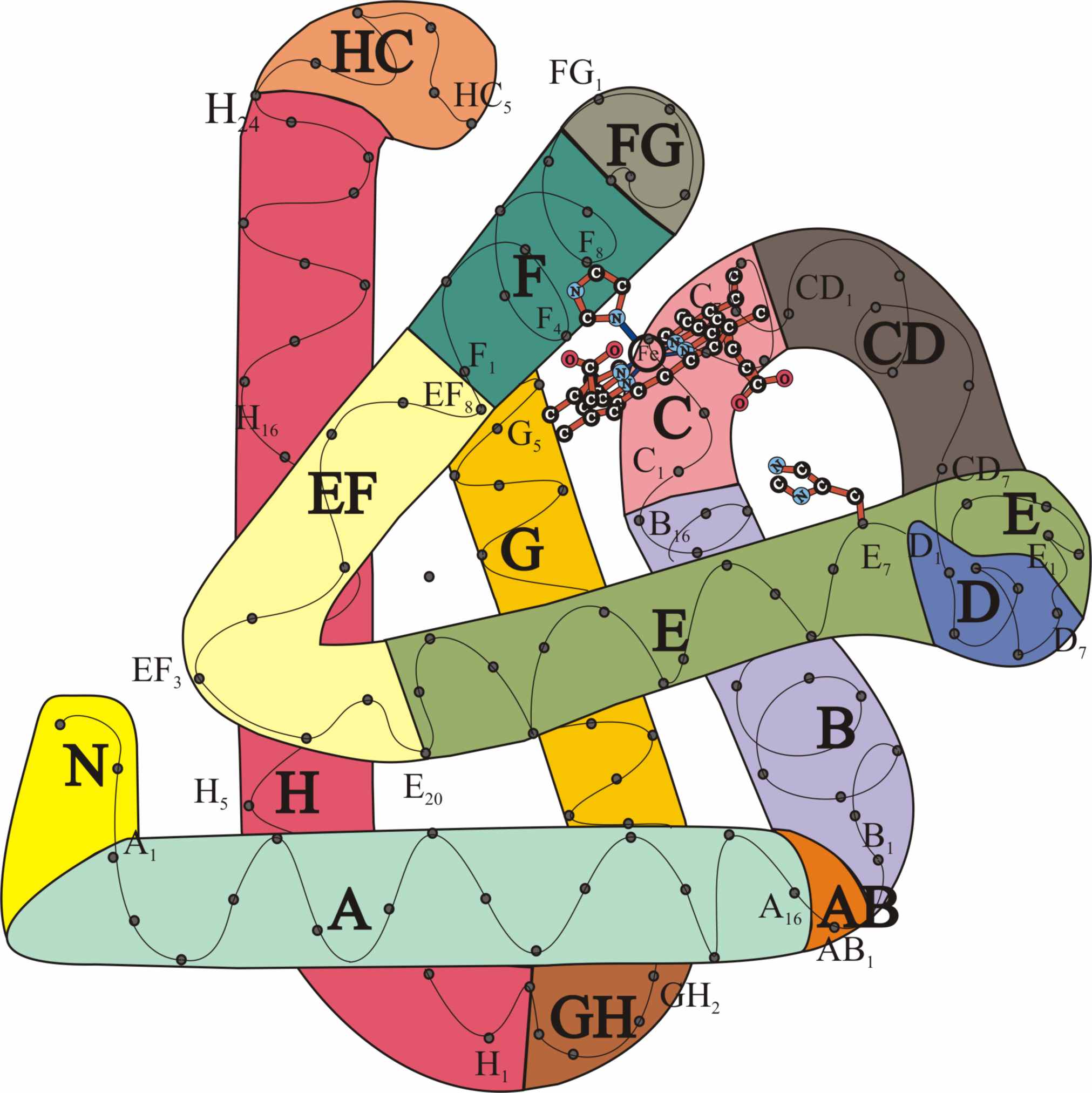
Fig.12
La
estructura de plegado en pico de paloma se debe a las interacciones débiles:
enlaces de hidrógeno, de Van der Waals e incluso alguna de tipo iónico o
puentes salinos entre los restos iónicos de carga contraria de ramificaciones
de aminoácidos. De esta forma el hemo que se inserta por la histidina proximal
(aminoácido 93), conecta el seguro de la joya con la región F, en la vuelta
de la segunda espiral (fig.13). Si se rompieran algunas interacciones débiles
y se abriera la cavidad, el Fe2+ quedaría desprotegido, permitiendo
la apro-ximación de moléculas de agua, oxidándose a Fe3+, y ocupándose
la sexta posición de coordinación reservada al oxígeno, con lo que no cumpliendo
su función, perderíamos la vida.
Cuando la corona se inserta en
la hemoglobina, dado que es un tetrámero formado por dos cadenas α
con 141 aminoácidos en las que el pico de la paloma ha desaparecido, y otras
dos β, con 146 aminoácidos en las que respecto a la mioglobina ha desaparecido
el segmento AB, son necesarias cuatro unidades (cuatro coronas), que se
insertan respectivamente a la histidina
proxi-mal (F-8), llamada así en oposición a la histidina distal que no se
coordina al hierro y que por su parte inferior es el ángel guardián de la
sexta posición de coordinación, al impedir que se aproxime todo lo que no
sea oxígeno, y una vez que entra éste, cierra la puerta evitando la entrada de otro elemento pernicioso (fig14).
En los soportes α y β,
la histidina de anclaje son los aminoácido 87 y 92 respectivamente, mientras
que las respectivas distal serían los 58 y 63.
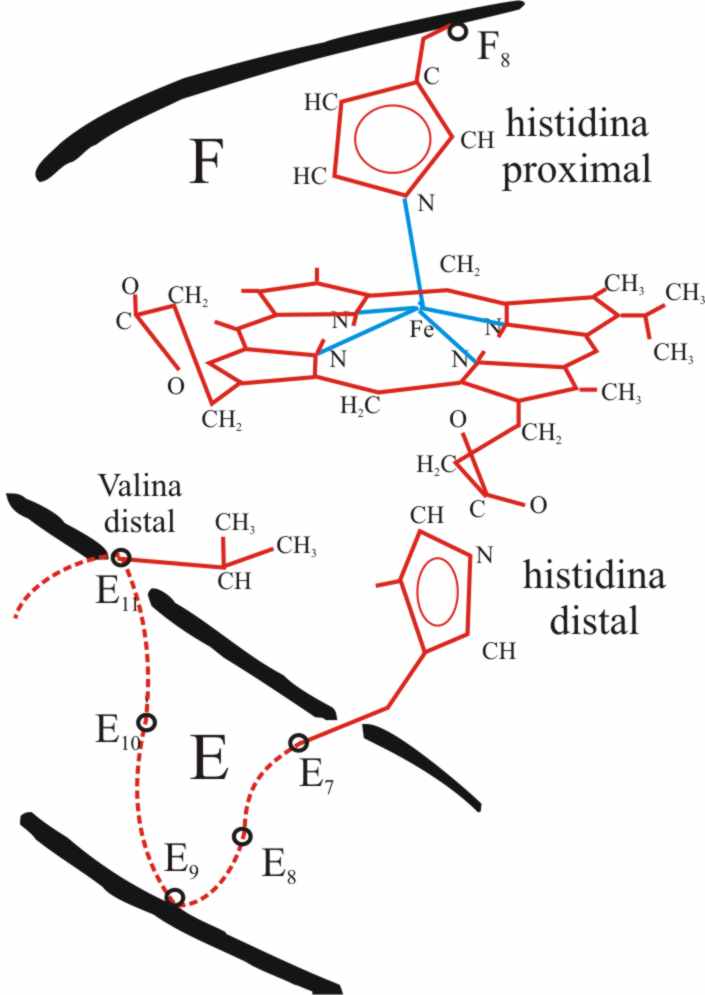
Fig.13
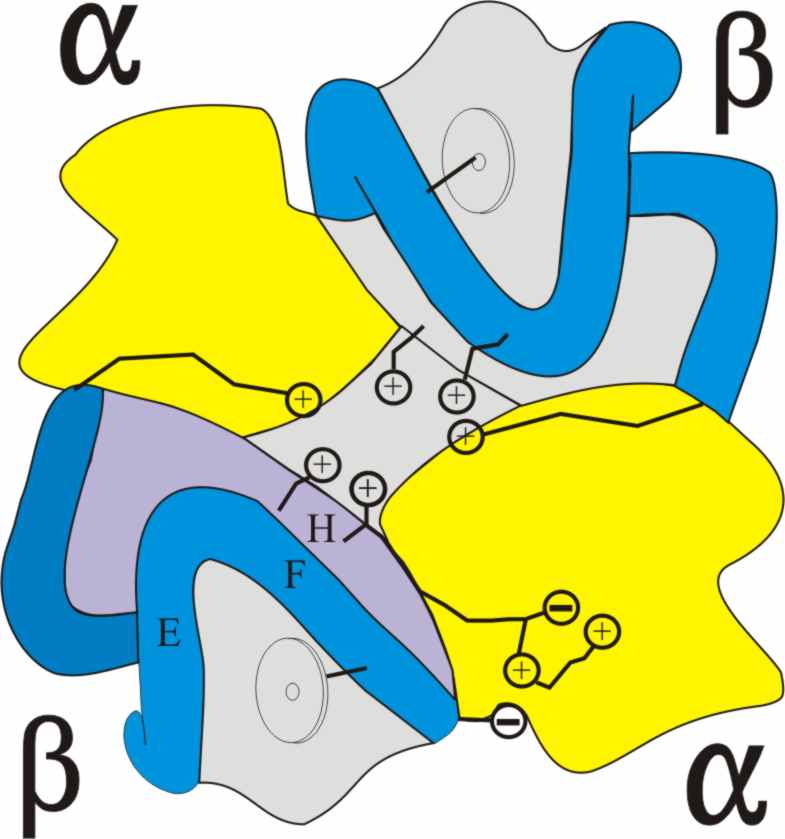
Fig.14
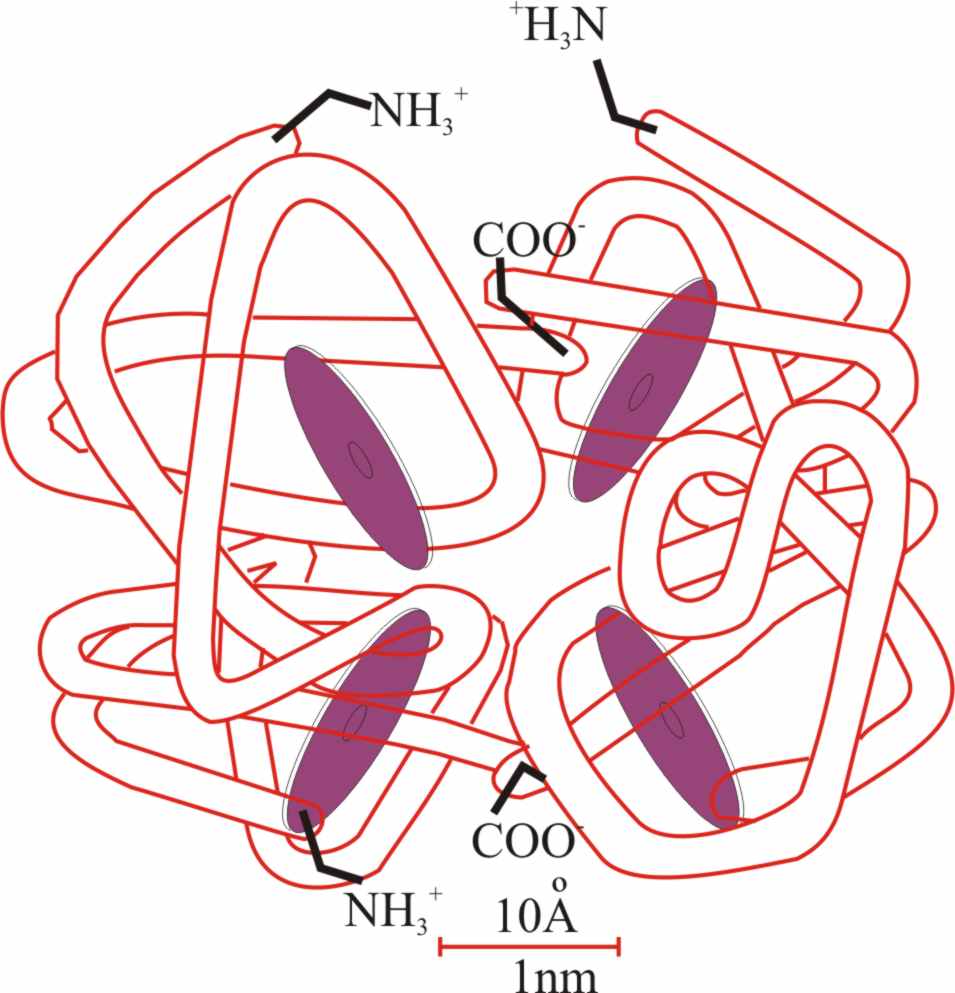
Fig.15
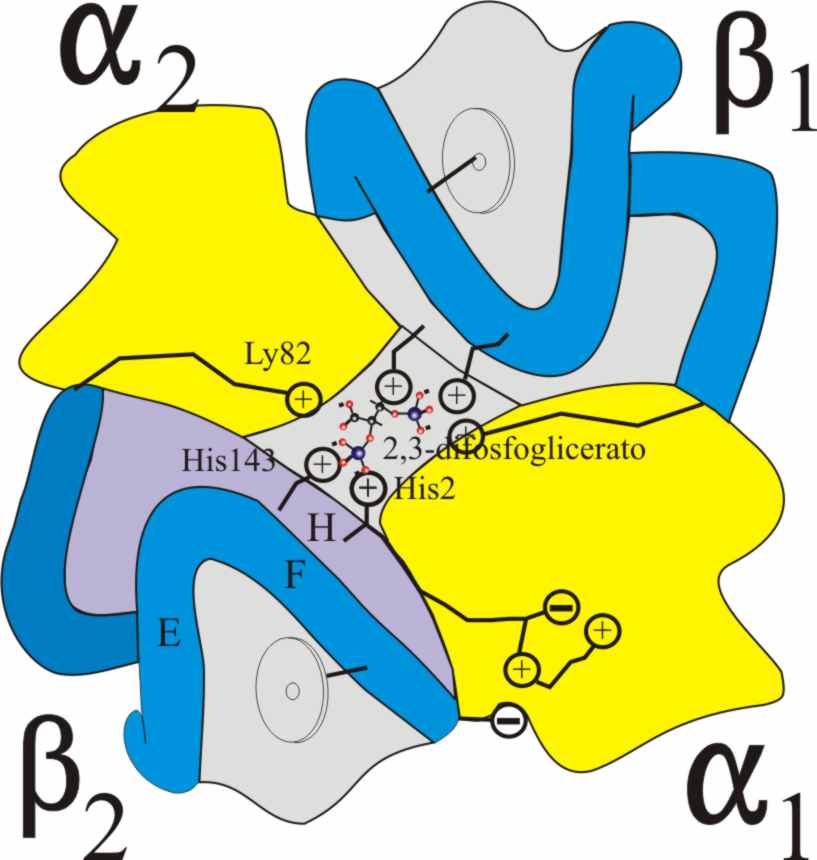
Fig.16
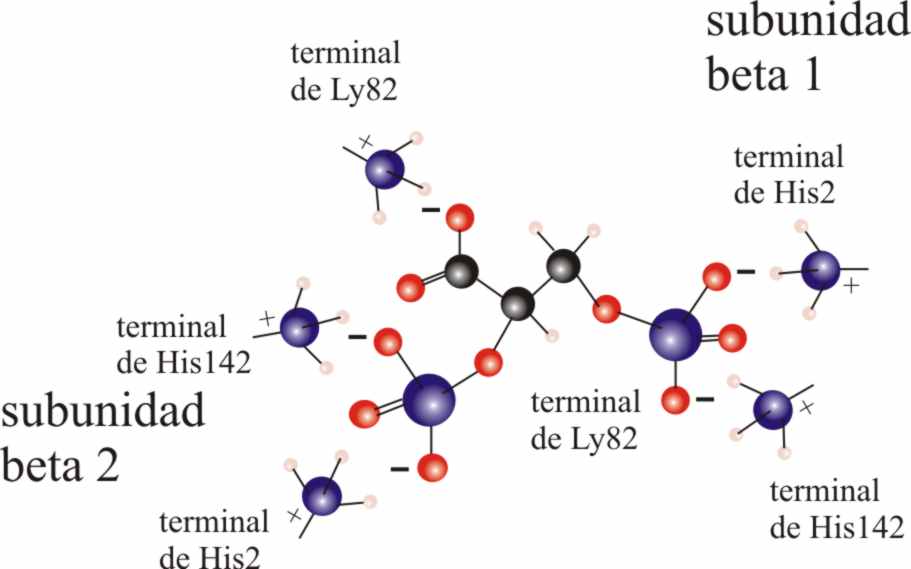
Fig.17
Las interacciones atractivas entre las cadenas a, y entre éstas con las b, se detallan
en la fig.18
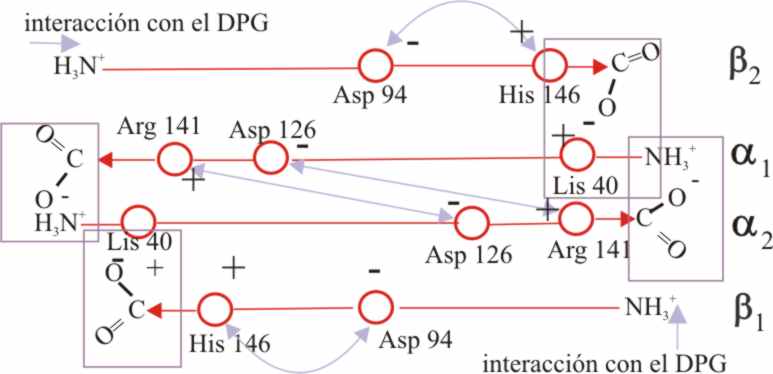
Fig.18
Dado que las cabezas de los monómeros
contienen un resto positivo y las colas otro negativo, las uniones entre ellos
originarán la disposición encontrada que reforzará la simetría tetraédrica
(fig.19).
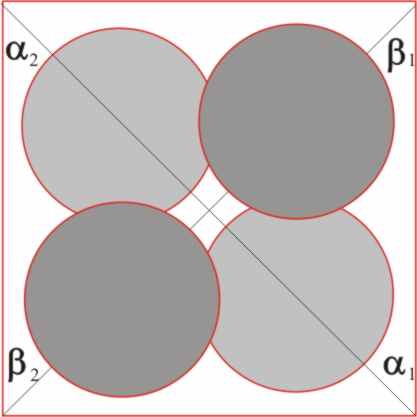
Fig.19
[1]
El término de hemoglobina, procede
del alemán Berzelius, que en Lehbuch er Chemie, habla de la materia colorante
de la sangre como Hämatoglobulin, que lo hace del griego haimatos (sangre),
y globulin (por la forma esférica). También la denominó Blutroth. Realmente ya existían términos parecidos como
Hematosine, propuesto por Chevreul en 1814, para
la materia colorante de la sangre. El término alemán Hämaglobin, está
constatado desde 1867.
[2]
Porfirina procede del griego πόρnυρoς (púrpura) que aunque actualmente
tiene el significado de un color "entre el rojo parduzco y el gris
azulado pasando por el violeta", según concepto histórico definido
por C.E. Pellew, originalmente y en griego significaría "ser mezclado",
en función del mecanismo de preparación de la Púrpura de Tiro a partir
de los moluscos del género murex.
[3]
El hem
o heme, fue aislado y bautizado, por el francés LeCanu, en 1831, a partir
de la denominación griega para la sangre.
[4]
Una
base o sustancia electrónpardadora, será tanto más dura cuanto peor los
ceda.
[5]
Las letras e y t hacen referencia a agrupaciones
de 2 y 3 orbitales degenerados mientras que las g y u, lo
son de aquellos que conservan o no su signo al girar 1801. y corresponde
a las iniciales de las palabras alemanas (gerade y ungerade) que así lo
indican. En este caso, dado que
la disposición es de pirámide tetragonal (la simetría C4v), que no posee
los elementos necesarios, no se van a producir, si en cambio en la posteriores
disposiciones octaédricas. Las
letras a y b, hacen referencia a orbitales no degenerados,
simétricos o no a una rotación de 3601 y que se dispondrán sobre un eje vertical (principal)
u horizontal (secundario).
[6]
El asterisco hace referencia
a un orbital molecular antienlazante
[7]
. La ley experimental de Coulomb,
expresa que la interacción entre cargas Q y Q’, separadas por r, se mide por
![]()
[8]
En 1921, el inglés Barcroft, sugiere que debería existir una tercera
sustancia que interfiriera con la hemoglobina y modificara su afinidad
por el oxígeno. Esta sustancia será aislada de la sangre canina cuatro
años después, por Greenwald, que indica se trata de “un nuevo tipo de
componente del ácido fosfórico”. En 1967, se identificó como el 2,3-difosfoglicerato
(DPG), mediante la colaboración de dos equipos de las universidades norteamericanas
de Columbia y Virginia.

Fig.8