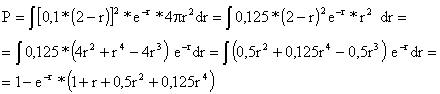ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Orbitales s con
ayuda de la hoja de cálculo EXCEL
Las ecuaciones que se suelen encontrar sobre los orbitales s están dadas en coordenadas polares
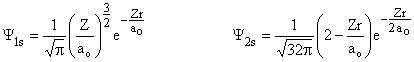
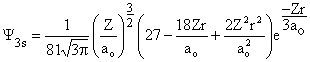
Los orbitales s no tienen componentes angulares por lo que es posible realizar los cálculos con una hoja adecuada de cálculo como por ejemplo Excel.
Para el átomo de hidrógeno Z=1 y utilizando para r unidades del radio de bohr resulta
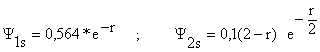
![]()
Orbital Y1s
Dando valores a r se obtiene la representación gráfica
del orbital (figura 1)
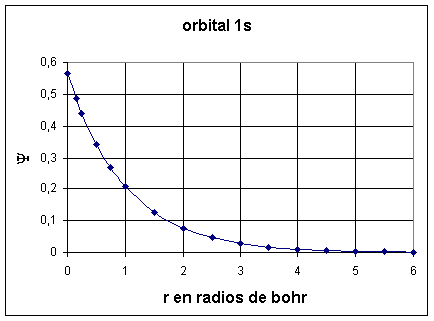
Fig.1
La
función de onda disminuye exponencialmente
y a cinco radios de bohr es prácticamente nula.
Teniendo en cuenta que la
interpretación de Y2 está
relacionada con la probabilidad de encontrar al electrón en una zona del
espacio
![]()
se
puede hacer otra representación
gráfica. Con centro en el núcleo consideramos una capa esférica de radio
r y espesor dr, el volumen de esa capa esférica es
![]()
Hacemos la representación
gráfica de
![]() frente a r ( fig 2)
frente a r ( fig 2)
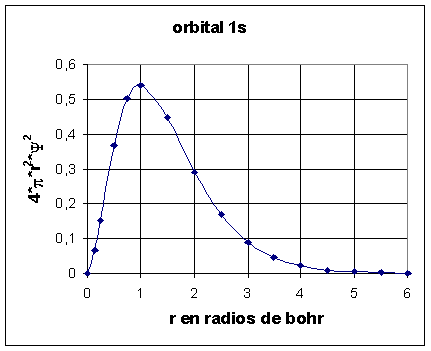
Fig. 2
La curva de la figura 2 nos
dice:
a) que la máxima
probabilidad de encontrar al electrón es a una distancia de un radio de
bohr
b) el área bajo la curva mide la probabilidad de encontrar
al electrón. Dado que la curva se extiende hasta el infinito esa área
vale 1 o sea probabilidad 100%.
En general la representación
de la probabilidad se limita a 0,9 (90%). Si
medimos el área comprendida entre r = 0 y r
![]() 3 radios de bohr, el área vale aproximadamente 0,9. En consecuencia el
orbital es una esfera centrada en el núcleo y cuyo radio es aproximadamente
igual a 3 radios de bohr
indica que en ese volumen la probabilidad de encontrar al electrón
es el 90%.
3 radios de bohr, el área vale aproximadamente 0,9. En consecuencia el
orbital es una esfera centrada en el núcleo y cuyo radio es aproximadamente
igual a 3 radios de bohr
indica que en ese volumen la probabilidad de encontrar al electrón
es el 90%.
Si en vez de dibujar el orbital
tratamos de representar la probabilidad de encontrar al electrón, mediante
un diagrama de puntos, dibujamos
un círculo cuyo radio es aproximadamente 3 radios de bohr
(con mayor precisión 2,6 radios de bohr) en
una imagen de puntos como la de la figura 3.
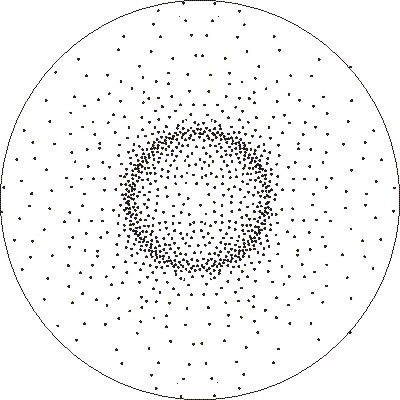
Nota
Este dibujo se hizo a escala.
Originalmente se tomó 8mm=1 Bohr,
haciendo circunferencias concéntricas, cada milímetro, después de fueron
insertando punto a punto proporcionalmente al indicativo de densidad de
probabilidad radial. El perímetro del OA, está hecho a partir del 90%,
o sea 2,66 bohr, o sea
Si imprime este dibujo esa escala varía, pero siempre encontrará que la región de máxima probabilidad se encuentra a 1 bohr de distancia del núcleo.
Orbital Y2s
Dando valores a r en la función
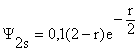 se obtiene la curva de la figura
4
se obtiene la curva de la figura
4
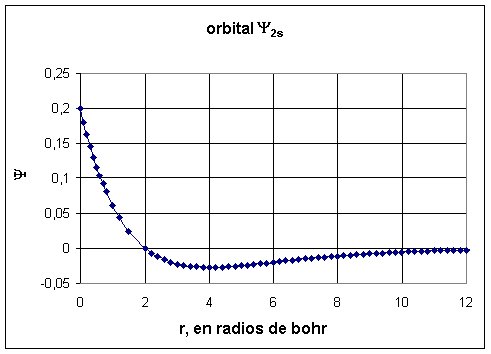
Fig.4
La figura 4 nos indica que la función de onda entre r =0 y r =2 es positiva y a partir de
r =2 es negativa, siendo nula en r =2. Prácticamente a unos 12 radios de bohr la función de onda es nula.
La representación espacial de la función de onda es una esfera pero debido a que se anula su valor en r =2 y además toma valores positivos y negativos no es posible hacer una representación tridimensional clara.
Si dibujamos la función
![]() frente a r obtenemos la figura
5.
frente a r obtenemos la figura
5.
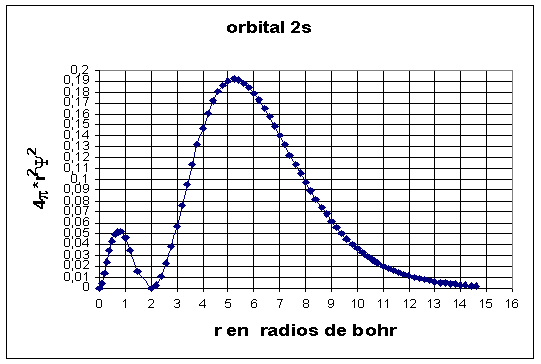
Fig. 5
Si se comparan las figuras 2 y 5, se observa que el primer máximo del orbital 2s está más cerca del núcleo que el máximo del orbital 1s.
El área bajo la curva mide
la probabilidad de encontrar al electrón. Si nos limitamos a una probabilidad
del 90%, el área bajo la curva comprendida entre r =0 y aproximadamente r = 9,5 radios de bohr
contiene esa probabilidad. La representación bidimensional, en un diagrama
de puntos, es la fig 6.
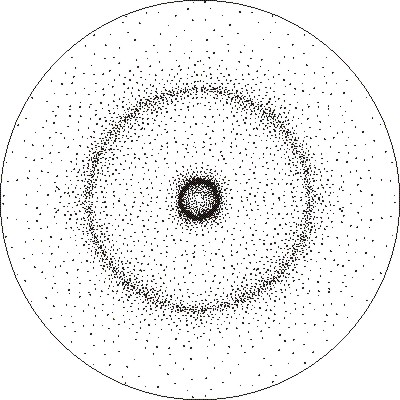
Fig.6
Orbital Y3s
Dando valores a r en la función
![]() se obtiene la curva de la figura
7.
se obtiene la curva de la figura
7.
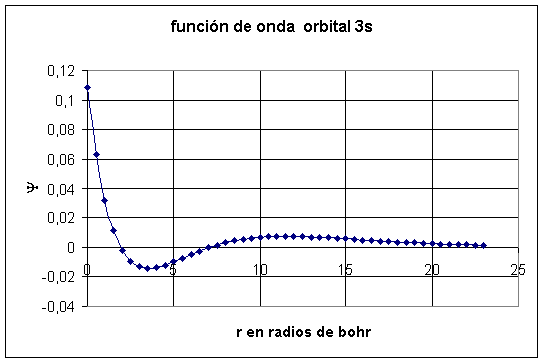
Fig.7
La figura 7 nos indica que la función de onda presenta dos nodos
Si dibujamos la función
![]() frente a r obtenemos la figura
8
frente a r obtenemos la figura
8

Fig. 8
El área bajo la curva mide la probabilidad de encontrar al electrón. Si nos limitamos a una probabilidad del 90%, el área bajo la curva comprendida entre r =0 y aproximadamente r = 20 radios de bohr.
Si se comparasen los tamaños
de los orbitales para el 90 % de probabilidad el orbital 2s sería aproximadamente
3 veces mayor que el 1s y el 3s
aproximadamente 6 veces mayor
Cálculos de la probabilidad más precisos
La probabilidad de encontrar
al electrón es
![]() . Si consideramos una capa esférica de radio r y espesor dr tenemos :
. Si consideramos una capa esférica de radio r y espesor dr tenemos :
![]() .
.
Para el orbital 1s P=
![]()
Con la hoja de cálculo Excel
representamos P frente a r (fig. 9)
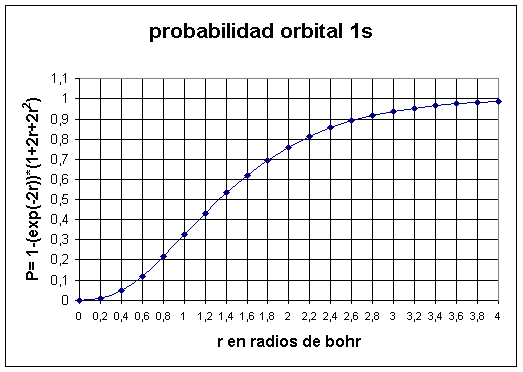
Fig.9
Una probabilidad del 90 % de encontrar al electrón es tal como indica la gráfica
r = 2,6 radios de bohr
Para el orbital 2s
Con la hoja de cálculo Excel representamos P frente a r (fig. 10).
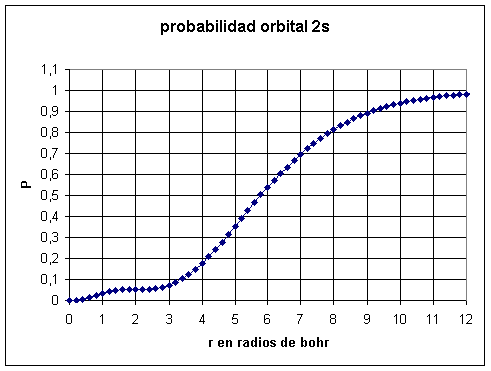
Fig. 10
Una
probabilidad del 90 % de encontrar al electrón es tal como indica la gráfica
de la figura 10, r
![]() 9 radios de bohr.
9 radios de bohr.
Para el orbital 3s
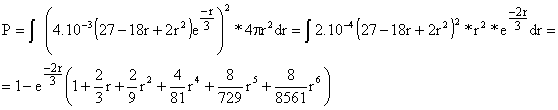
Con la hoja de cálculo Excel
representamos P frente a r (fig. 11).
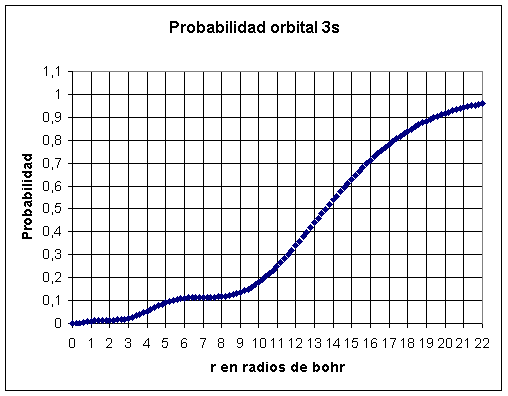
Fig. 11
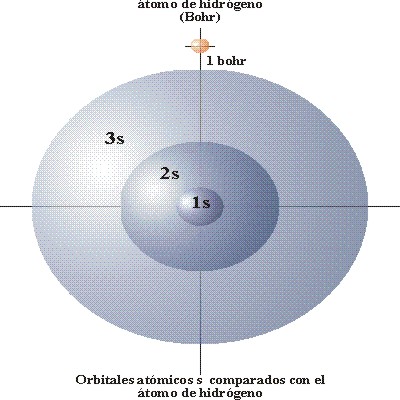
Fig. 12