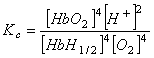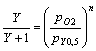ENSEÑANZA
DE LA FÍSICA Y LA QUÍMICA
sección:
TEMAS DE FÍSICA Y QUÍMICA
Consecuencias estructurales del descenso del Fe(II): Curvas
de saturación y Efectos modificadores
Vamos a estudiar las curvas de
afinidad de la mioglobina y de la hemoglobina frente al oxígeno, así como
los factores modificadores de dichas curvas.
Se define la fracción de saturación
Y, como la relación entre el número de moles unidos a la proteína en cada
instante, frente al máximo número de moles que pueden unirse. Si se relaciona
con la presión parcial se tiene una función que para la mioglobina es
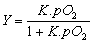 , siendo K, la constante de equilibrio entre la oximiogloblina y la desoximioglobina:
, siendo K, la constante de equilibrio entre la oximiogloblina y la desoximioglobina:
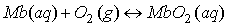
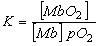
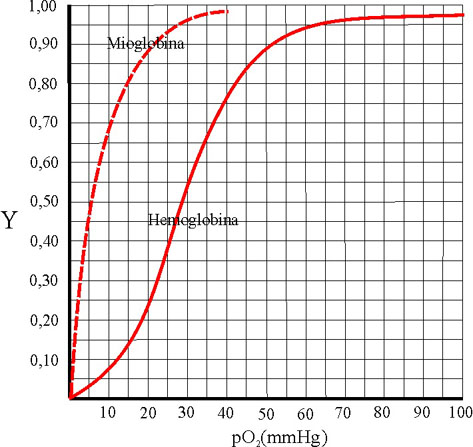
Fig.39
Esta función representada corresponde
a una hipérbola.
Sin embargo en la hemoglobina,
debido a ser una proteína alostérica, la curva representativa es del tipo
sigmoideo. De esta forma las gráficas comparadas en función
de la presión del oxígeno en mmHg, son las siguientes en condiciones normales
(fig.39):
La forma sigmoidea corresponde
a la sucesiva absorción del oxígeno, debido al efecto cooperativo. No está
muy claro el posible comienzo, pero evidentemente, la línea de máxima pendiente
de la curva corresponde a la eliminación del DPG, en la oxigenación de la
cadena beta con aproximación de las subunidades. La relación forma de la curva-absorción
de oxígeno seguiría una secuencia, dada en la fig. 40.
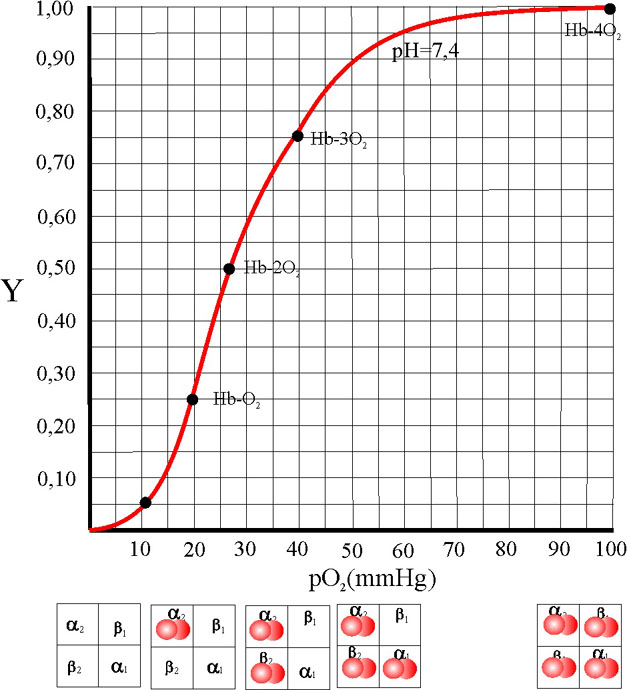
Fig.40
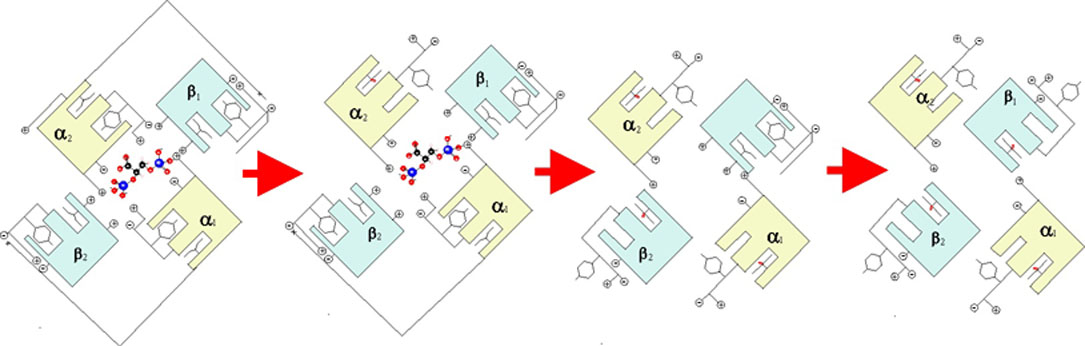
Fig.41
En la secuencia de la fig.41, se
observa el cambio de configuración de las subunidades, así como del hierro(II),
en el hueco de la proteína, con eliminación entre el segundo y tercer paso
del DPG, por lo que aumenta considerablemente la absorción de oxígeno, y por
lo tanto la fracción de saturación, que pasa del 25% al 50%, para un cambio
muy pequeño de la presión de oxígeno.
La variación de la concentración
de DPG, modifica la forma de la curva sigmoidea, lo cual explica la mayor
o menor afinidad por el oxígeno, hasta en 35 puntos en el % de la fracción
de saturación (fig.42)
La mayor pendiente de la curva
sigmoidea, corresponden a variación de la presión parcial del oxígeno entre
20 y 40 mmHg, este hecho tiene gran importancia, ya que la presión en los
alvéolos pulmonares es de 100mmHg, con lo cual la fracción de saturación
de la hemoglobina alcanza su valor máximo, con lo que se satura de oxígeno
transportándolo a los tejidos. En estos la presión oscila entre 40 y 20
mm de Hg, variando la fracción de saturación entre 0,32 y 0,77. Cuando se
efectúa un trabajo muscular, la presión disminuye y también la fracción
de saturación (Fig. 43) de la hemoglobina, muy inferior a la de la mioglobina,
por lo cual aquella libera el oxígeno
en beneficio de esta última, cuya fracción de saturación a esta presión
es de 0,85.
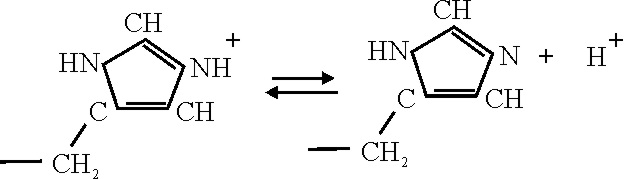
La ruptura de los puentes salinos
a consecuencia del giro, por la bajada del ión ferroso hasta el centro del hemo, al reducirse su radio
por cambio de la estructura del complejo, va a traer otras consecuencias.
Así en el caso del enlace salino histidina-aspártico, va a dar lugar a que la histidina ceda un protón, según el equilibrio:
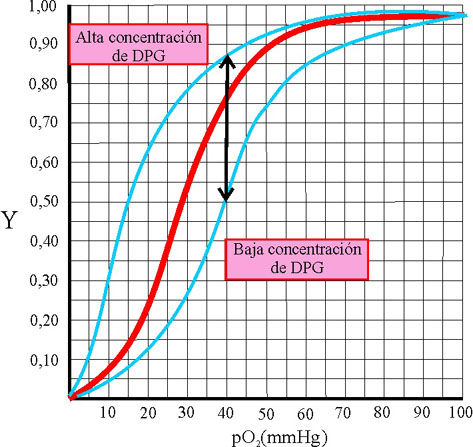
Fig.42
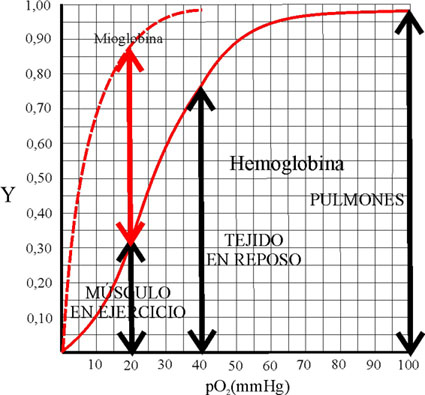
Fig.43
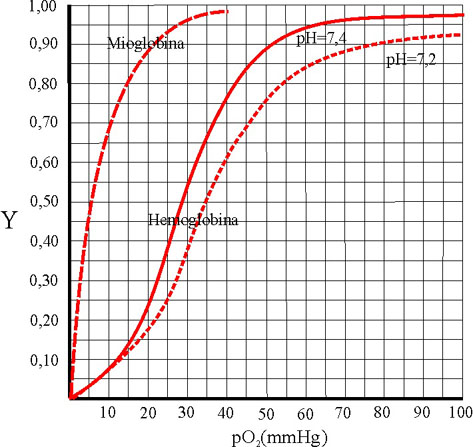
Fig.44
Por lo tanto se va a producir una
relación entre la formación de la oxihemoglobina, el aumento de la concentración
de protones con disminución de pH. De esta forma se van a desprender por lo
menos dos protones, por cada cuatro moléculas de oxígeno absorbidas, según
la siguiente reacción globalizada:
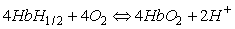 con una
con una
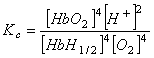
El equilibrio depende de la concentración
de hidrogeniones, y cualquier modificación del pH o cualquier factor que lo
altere puede desplazarlo por aplicación del Principio de Le Chatelier-Braun.
Por eso es tan importante que el pH del plasma sanguíneo se mantenga en el
7,4.
Este efecto de influencia del pH,
se conoce como efecto Bohr, ya que
fue descubierto por Christian Bohr, padre de Niels, Nóbel de Física de 1922,
y abuelo de Aage Bohr, Nóbel de Física de 1975, pero no lo fue
en un proceso de modificación estructural de la oxihemo-globina, pues
lo hizo en 1903, junto con sus colaboradores Hasselbalch y Krogh, cuando no
se conocía su estructura, observando la disminución de la afinidad de la hemoglobina
por el oxígeno, cuando se disolvía dióxido de carbono en la sangre. Este hecho
se debía a que la anhidrasa carbónica
de los glóbulos rojos catalizaba la reacción del dióxido de carbono con el
agua, dando hidrógenocarbonato y un protón, por eso disminuye el pH.
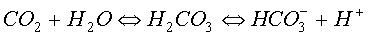
Hecho que a su vez disminuye la
afinidad de la hemoglobina por el oxígeno(fig.44). Más del 85% del dióxido
de carbono transportado por la sangre se realiza en forma de hidrógenocarbonato,
distribuyéndose entre el suero y los eritrocitos en la proporción de 4 a 1.
Por lo tanto una mayor concentración
de dióxido de carbono en la sangre, altera la curva sigmoidea, tal como se
aprecia en la figura 45.
El efecto Bohr va a producir que
grupos ácidos tales como el dióxido de carbono puedan estabilizar la molécula
de hemoglobina, que es capaz de transportarlo aunque sin combinarse con él,
dado que es un aceptor de pares de electrones (ácido de Lewis) y no un dador,
capaz de formar complejos. La desoxihemoglobina en los pulmones cede el dióxido
de carbono y toma el oxígeno.
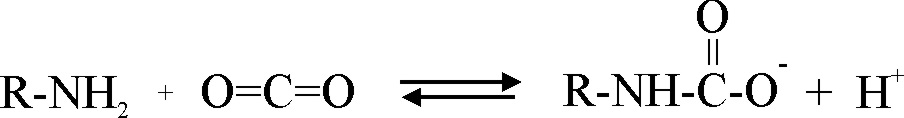
Todavía existe otro proceso capaz
de producir protones en la sangre,
vinculado al transporte del dióxido de carbono, ya que al actuar como un ácido
de Lewis, interacciona con los pares no ligantes del nitrógeno en los N-terminales
de la hemoglobina, produciendo carbamatos y liberando un protón según el proceso:
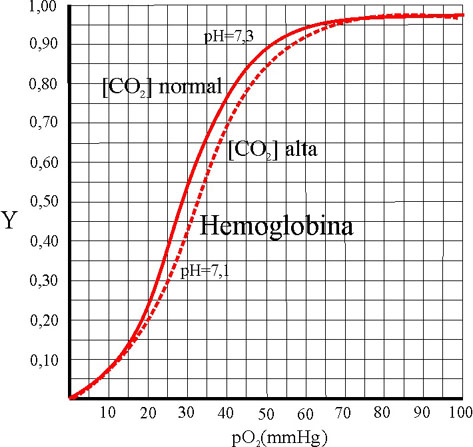
Fig.45
El efecto Bohr tiene consecuencias
muy curiosas, ya que cuando hacemos algún esfuerzo especial en los tejidos
musculares en los que necesitaremos un mayor aporte de oxígeno, se producirá
ácido láctico que suministre los H+ necesarios para que el equilibrio
se desplace hacia la izquierda, pero en contrapartida, el ácido láctico cristaliza
en el músculo provocando la sensación de agujetas.
En algunos casos y excepcionalmente los
protones producidos pueden estabilizar a las moléculas unidas al oxígeno.
Cuando esto ocurre aumenta la afinidad por el oxígeno al disminuir el pH.
Este efecto se conoce con Bohr invertido o negativo. La mayoría de las hemoglobinas
exigen efecto Bohr negativo a pH alrededor
de 6, aunque a este pH la vida humana sería imposible, si lo sería en otras
especies. La incapacidad de las hemoglobinas para retener el oxígeno a bajos
pH, se conoce como efecto Root, descrito por R.W.Root en 1931.
Cuando por cualquier motivo, se
produce una alteración en el transporte de oxígeno por la hemoglobina
de la sangre (ateroesclerosis, fallo cardíaco etc.), entonces las mitocondrias
al no recibir dicho oxígeno, comienzan a generar energía a través de glucólisis,
en la cual las moléculas de glucosa y glucógeno
se descomponen formando ácido
láctico. De esa forma por cada mol de glucosa que se descompone en dicho proceso
se obtienen dos moles de ATP (energía en forma de enlaces de fósforo), y otros
dos de ácido láctico, con lo que el pH sanguíneo puede descender hasta 6,
provocando una cadena de sucesos para equilibrar la carga eléctrica celular,
que llevan a la muerte.
También la temperatura modifica
la forma de la curva. Al aumentar, disminuye la afinidad, especialmente en
los tejidos, esto a presión de 40 mmHg (fig.46). El aumento de temperatura
corporal, es un indicativo tradicional de posibles enfermedades o situaciones
de malestar, por eso en todas las casas existe un termómetro clínico. Dicho
aumento está vinculado a un aumento
de ritmo en el metabolismo humano; un grado de aumento incrementa aproximadamente
en un 11% el ritmo de nuestro metabolismo,
para atajar la enfermedad, acelerando la producción de enzimas, y aumentando
la velocidad del ritmo cardíaco, y por lo tanto la velocidad de la sangre.
Todo ello conlleva a que al disminuir
la fracción de saturación de la hemoglobina, ésta desprenda más fácilmente
el oxígeno en los tejidos.

Fig.46
![]() , siendo K, la constante de equilibrio entre la oximiogloblina y la desoximioglobina:
, siendo K, la constante de equilibrio entre la oximiogloblina y la desoximioglobina:
![]()
![]()