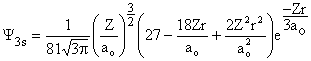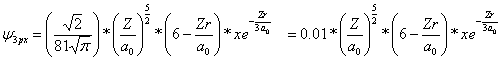ORBITALES
HÍBRIDOS
sp
La
enseñanza del tema de orbitales híbridos
(OH) en
En
primer lugar, la forma. Aparecen con
un lóbulo muy grande y otro muy pequeño, debido a la combinación lineal de
los orbitales s y p, pero ¿tienen siempre esa forma?.
¿Es igual que se mezclen un orbital s
y uno p que un s y dos o tres orbitales
atómicos p?. ¿Tiene la misma forma el orbital híbrido
producido por la mezcla de un 2s y un 2p, que un 3s y un 3p?.
Siempre se dibujan iguales, pero no lo son.
Nunca
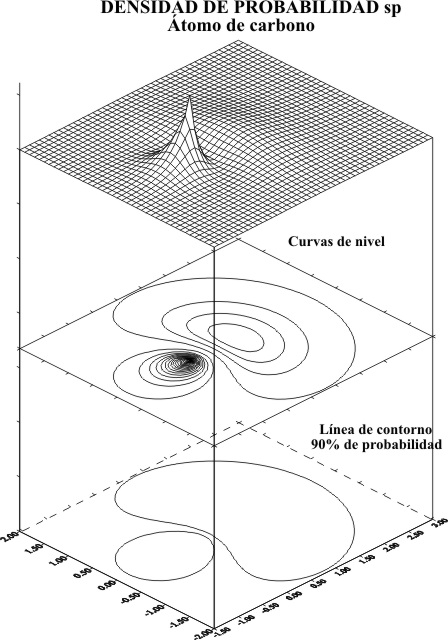
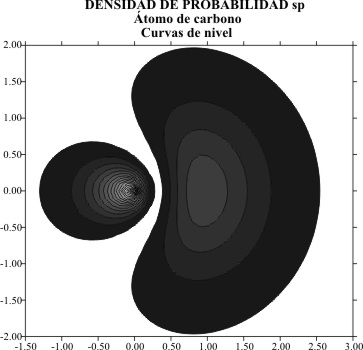
se habla de la densidad de probabilidad en las zonas que delimitan los lóbulos
¿dónde están las curvas de los niveles de probabilidad?
Para
aclararlo usaremos el mismo sistema empleado en el tratamiento de los orbitales
atómicos p, d y f, trabajando con funciones de onda en coordenadas cartesianas.
Las
funciones de onda que se combinarán para
formar dos orbitales híbridos sp son:
![]() y
y
![]() (1)
(1)
(debe recordarse que el término
![]() , procede de la condición de normalización)
, procede de la condición de normalización)
Ahora bien, la función de onda 2s como se ha visto tiene por ecuación general:
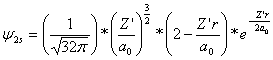 (2)
(2)
mientras que la
2p
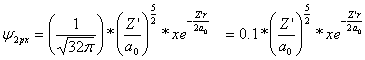 (3)
(3)
Hasta
ahora se habían usado para el hidrógeno, esto es en orbitales atómicos hidrogenoides
en los que Z’=1. Sin embargo los orbitales
atómicos que normalmente se hibridan corresponden a átomos característicos,
como son C, N, etc, y por lo tanto habrá que introducir en las ecuaciones
2 y 3, el valor de Z’ que es la carga nuclear efectiva de cada átomo, esto
es la carga nuclear modificada por los parámetros de Slater. Este hecho es
el factor que modificará esencialmente el tamaño del orbital híbrido.
En
nuestro trabajo tomaremos para el C, Z’=3,15.
Para el N, Z’=3,8. Para el O, Z’=4,45 y para el F, Z’=5,1
Al
llevar la ecuaciones 2 y 3, a la 1,
y aplicarla al carbono, considerando la longitud en unidades bohr (a0=1),
dan lugar a la expresión:
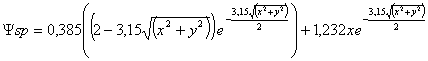 (4)
(4)
Esta expresión correspondería
a una de las combinaciones lineales; bastaría con cambiar el signo para tener
la otra.
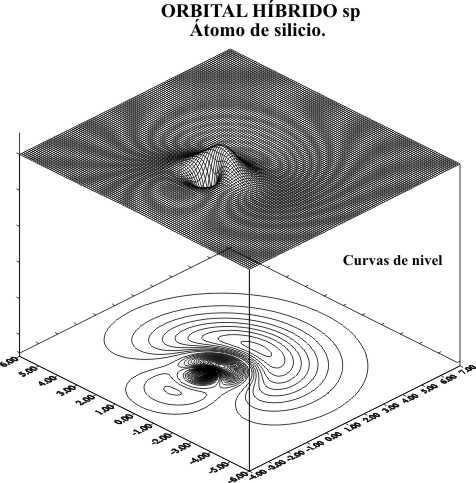
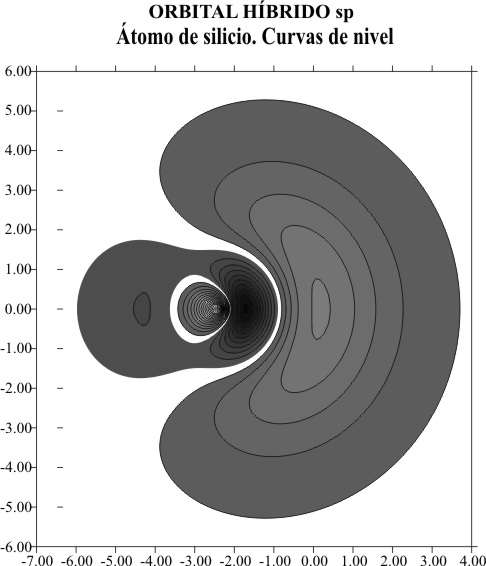
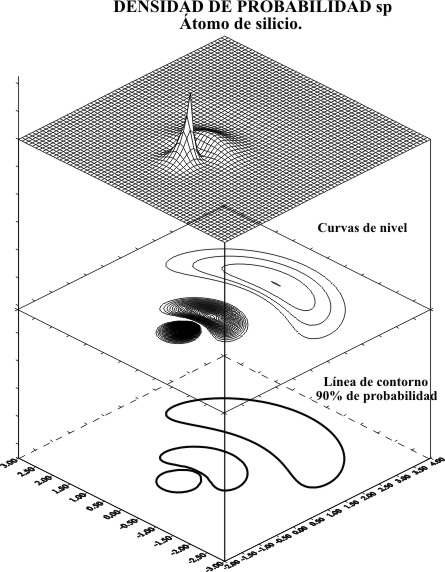
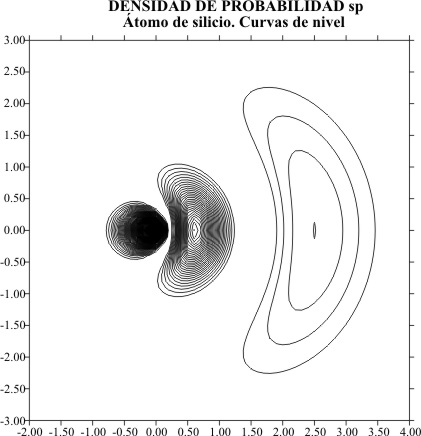
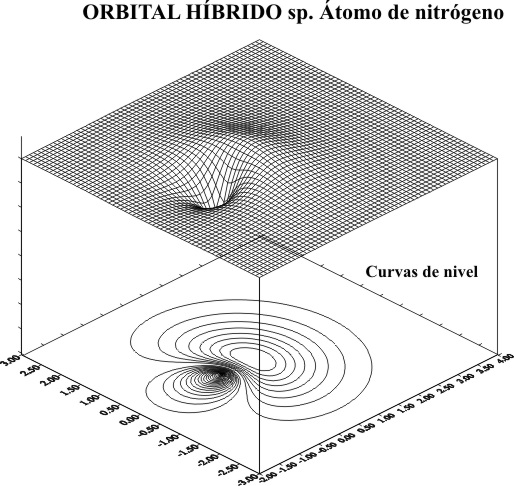
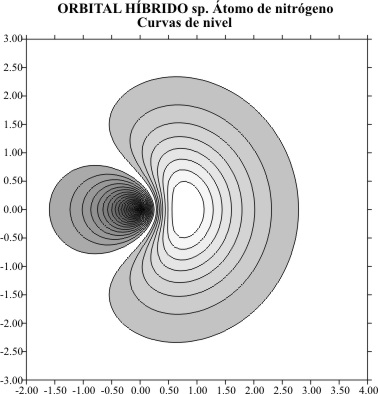
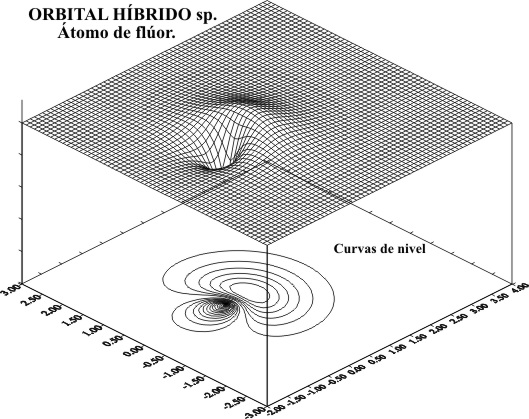
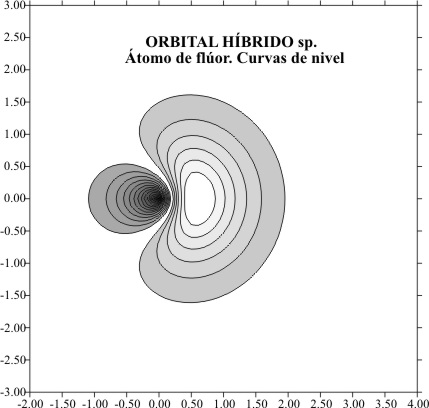
Para
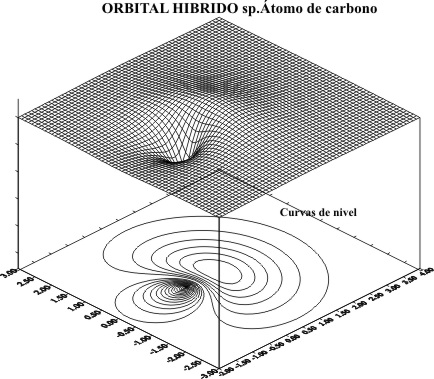
representar el OH, se usará el programa de dibujo tridimensional que se ha
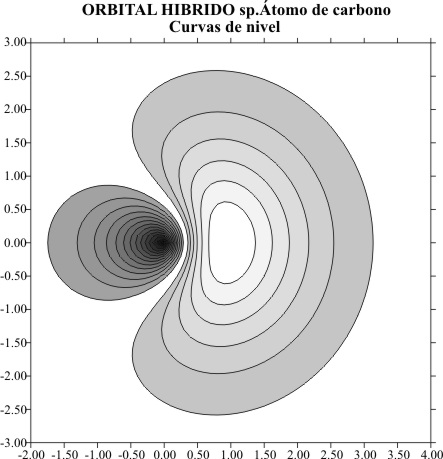
empleado en trabajos anteriores obteniéndose para el carbono, el gráfico superficial de la fig.1 , con el corte de líneas de nivel, que se puede apreciar
mejor en la fig.2.
El programa genera una malla superficial, en la que cada
punto (x, y) corresponde valor de y. Como se trabaja sobre
el plano XY, se hace z=0.