Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
DESDE EL COSMOS HASTA NUESTROS
SENTIDOS, LA CURIOSA HISTORIA DE UN ELEMENTO EXTRAÑO: EL BERILIO (final)
El berilio, el sabor dulce y la berilosis.
El nombre de GLUCINUM que
se conservó durante bastante tiempo, se debía al sabor dulce de sus sales
más solubles, sulfato y cloruro, condición indispensable para notar dicho
sabor. El sistema empleado en su obtención partía del mineral berilia, se
fundía con carbonato potásico, y se evaporaba la masa fundida con ácido
sulfúrico; el sulfato de berilio, muy soluble se extraía con agua, a diferencia
de los otros sulfatos. Pues bien este sulfato provocaba esa sensación, a
parte de la muerte si se ingería en cantidad.
)Por qué las sales de berilio eran
dulces, lo cual motivó su primitivo nombre?
Los sentidos, y como tal los sabores,
implican un mecanismo que se traduce en una variación de polarización, para
que las diferentes concentraciones de iones potasio y sodio a través de
la membrana celular, produzcan una descarga, que en determinadas condiciones
es transportada hasta el cerebro, éste la interprete tal como hemos visto
al tratar de los colores.
En los sabores ácido y salado,
los causantes, son la carga del ion hidroxonio, y la de los iones salinos,
iones que producen interacciones o acciones eléctricas más intensas; por
eso cuando tomamos una comida muy salada o algo picante, cualquier postre
por muy dulce que sea no nos sabe a nada: domina otra sensación. Sin embargo
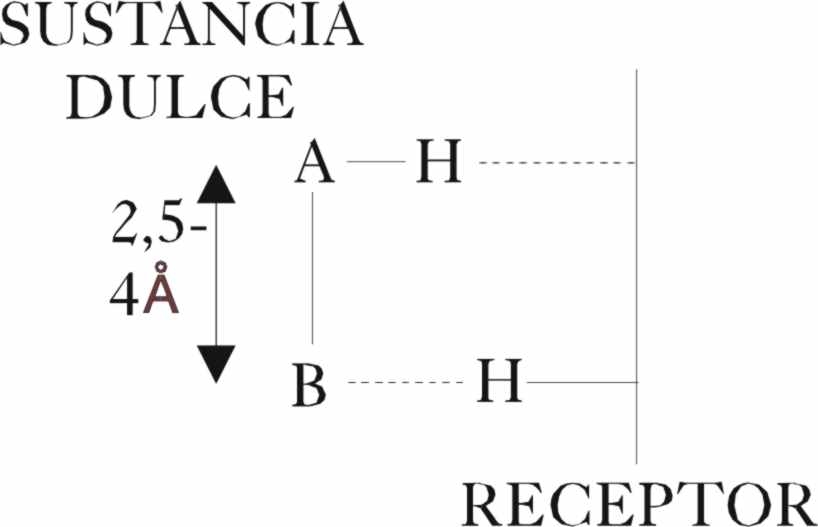
en los dulce y amargo, el problema es mucho más complejo, por que la interacción
con las papilas gustativas de la lengua se hace a través de interacciones
débiles por puentes de hidrógeno con las terminales proteínicas de aquellas,
que en determinadas condiciones se puede sustituir por otras más débiles,
siempre que tengan la geometría adecuada .

Fig.1
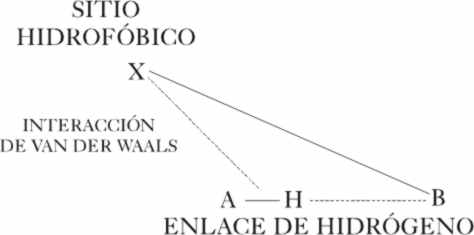
Fig.2
La introducción del grupo hidrofóbico
que modifica las energías de hidratación, explica la especificidad conformacional
del sabor dulce en algunas moléculas
Incluso
se puede complicar más por activación de las posiciones dadoras o receptoras
por grupos dispuestos en una determinada geometría espacial, como indica el
modelo Tinti-Nofre de 1991. Este modelo postula hasta ocho lugares de interacción
retomando los AH….B de Shallenberger e incluyendo el X de Kier como grupo
hidrofóbico G, pero completándolo con otros cinco, de los que el D (podría
ser un grupo saturado de carácter ácido), tiene un papel importante, mientras
que los otros cuatro, mas alejados E1, E2 XH e Y, simplemente
modifican aumentando o disminuyendo el carácter dulce
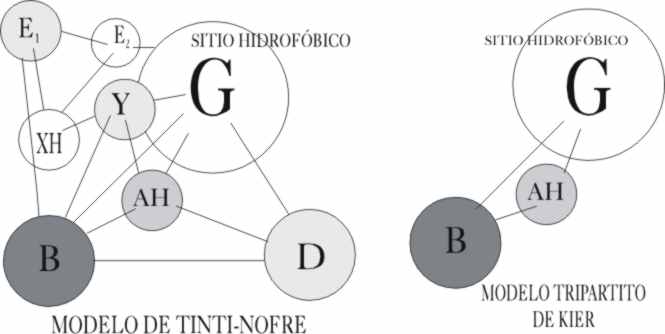
Fig.3
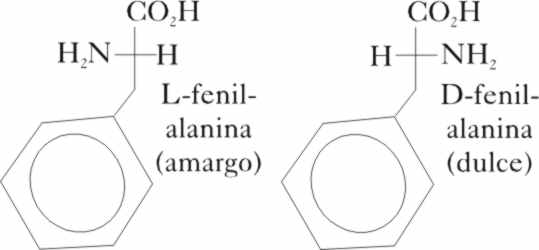
Fig.4
En el mundo inorgánico también
se produce el sabor dulce en determinadas sales muy solubles. Hay que tener
en cuenta que no todas las sales producen sabor salado, ni ácidos, sabor ácido
[1]
; también pueden provocar la sensación de dulce y amargo.
Esto va a ocurrir en sales anfóteras, como los cloruros situados a lo largo
de la diagonal marcada en el sistema periódico que comienza con el cloruro
de berilio y termina con el de plomo(II).
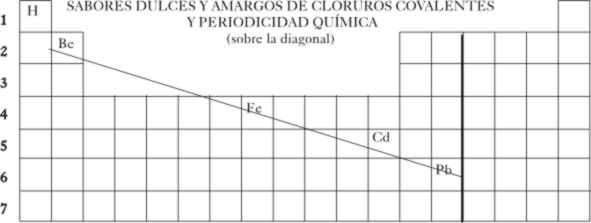
Fig.5
En este tipo se sales esas sensaciones
dependen de la energía debida a las interacciones atractivas de Coulomb (interacción
de Van der Waals) con los puntos receptores de la lengua y las proporcionadas
por la solvatación de los iones formados.
Como las interacciones de Van der
Waals se debilitan extraordinariamente al aumentar la distancia, por ello
el límite al que puede estar el grupo que llevará al sabor dulce o grupo glucóforo
deberá ser de 5,4D. Es lógico que si se pretender
reforzar una interacción de Van der Waals tiene que debilitarse la de solvatación
con el agua que hay entre la molécula saborizante y la punta de la lengua,
en el caso del carácter dulce, por eso se necesita la cooperación dirigida
en un sentido determinado del grupo hidrófobo (de ahí la importancia geométrica
del modelo Tinti-Nofre). Este grupo
(G) deberá disminuir esta energía de solvatación para potenciar la otra interacción
de forma que llegue a ser dominante. Quiere decir que no sólo la interacción
de hidrógeno puede proporcionar una sensación dulce o amarga, sino también
interacciones a través de ligandos (covalentes) y como en el berilio la acción
conjunta de varias interacciones, incluyendo la ión-dipolo.
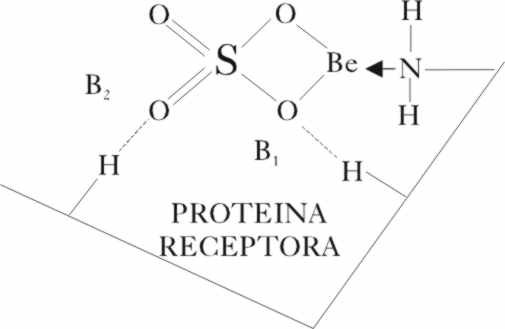
Fig.6
En nuestro caso, el ión Be2+,
es tan pequeño (0,3D), y tiene tal densidad de carga,
y es tan polarizante que actúa como un aceptor de pares de electrones (ácido
de Lewis), capaz de interaccionar con la base de Lewis proteínica (par electrónico
del N, o del O u HOMO, orbital molecular ocupado de mayor energía de la molécula
dadora), dispuestas con más abundancia en la punta de la lengua, de forma
parecida a como lo hace el H+, frente a los grupos oxígeno del
puente de hidrógeno, provocando una respuesta similar
[2]
. (fig.6)
Según la disposición del punto
receptor el puente de hidrógeno se puede hacer por el B1 o por
el B2, aunque ambas disposiciones son diferentes, envolviendo distinta
energía, ya que el O=, promueve un enlace de hidrógeno corto, mientras que
el O- lo es largo.
¿Cómo se produce la descarga eléctrica
que trasmitida al cerebro le haga comprender que se trata de un sabor dulce?
Aunque las conclusiones del congreso
sobre edulcorantes y teoría del sabor dulce, presentado en la Sociedad Química
americana , en agosto de 1993, no se ha definido totalmente sobre ello, existen
algunas hipótesis de trabajo actualmente en comprobación, muy importantes.
El mecanismo propuesto es parecido
al desarrollado en la visión de los colores. En aquella era el cierre del
canal del sodio, de la bomba sodio-potasio, localizada en la parte lateral
de las células el que provocaba la diferencia de potencial que generaba la
descarga.
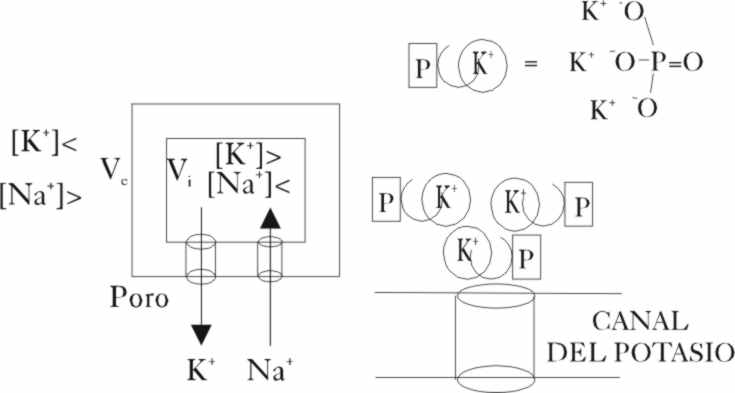
Fig.7
Así, la transmisión de la energía
producida en la interacción que genera el sabor dulce, sería lo que desencadenaría
el proceso. Lo hace a través de proteínas G que estimulan determinados enzimas
(adenilatociclasa
[4]
) que sintetiza el AMP cíclico con efecto multiplicador.
A su vez éste trasmite la energía a una kinasa que no logra abrir el ciclo
como ocurría con el GMP cíclico, pero en su proceso de activación consigue
mediante un ATP liberar ortofosfato(PO43-)
cuya afinidad por el K+ es notable, cerrando el poro del canal
del potasio
[5]
. De esta forma el AMP cíclico es el causante indirecto
del cierre del canal y la despolarización consiguiente.
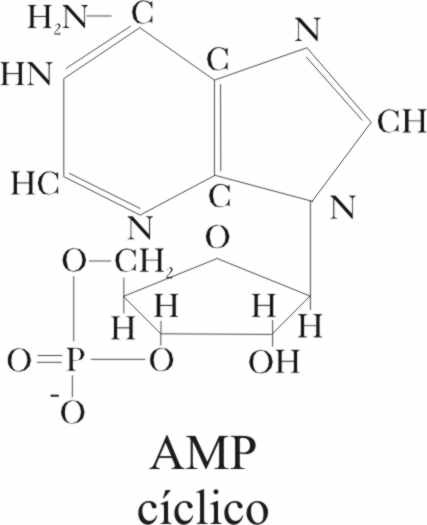
Fig.8
Hemos mencionado que el nombre
del berilio ha generador el briller francés y de ahí el término brillar, pero
¿por qué el berilio brilla como si fuera un metal?
El berilo que da nombre al berillium
realmente es un silicato de berilio y aluminio con una estructura en capas.
Las capas de silicatos
[6]
dejan una serie de huecos que serán ocupados por
los iones Al3+ y Be2+, los primeros en huecos octaédricos
(tienen mayor volumen) y los segundos en huecos tetraédricos
[7]
. Estos iones así dispuestos en los huecos de las
cadenas son los responsables de las propiedades que le otorgaron el título
de piedra preciosa. ¿Cómo lo hacen?
Estos metales aumentan el índice de refracción
del vidrio tal como los iones plomo que se usan en las mejores fábricas
europeas, con lo cual y de forma natural los cristales del silicato adquieren
propiedades semejantes a los brillantes pues la luz parece atrapada en ellos
ya que debido a su elevado índice de refracción
enseguida se alcanza el ángulo límite reflejándose hacia su interior.
Los iones Be2+ estimulan el brillo y por eso se mezclaron con
el fósforo para acentuar la fosforescencia de los tubos recubiertos de fosfatos
de berilio hasta que a partir de 1940 comenzaron a observarse unas inexplicables
muertes de obreros que habían estado implicados en la fabricación de esos
tubos.
En la metalurgia del berilio, el
sulfato que es la única muy soluble, tenía la dificultad de provocar una
gran concentración de iones Be2+, que lo convertían en un poderoso
veneno y ello era un grave problema por ser uno de los elementos que más
aplicaciones van a desarrollar en los últimos cincuenta años. El berilio
comunicaba al cobre una dureza y resistencia tremenda que lo asemejaba al
acero, pero sin ser magnético, por ello y debido a su especial ligereza,
lo sustituía en la fabricación de aviones, e instrumentos de precisión.
Su poca masa y su papel en la producción de neutrones
[8]
, hace que se utilicen en los reactores nucleares
para controlar su pérdida. Además no sólo podía actuar por vía digestiva
sino también por la respiratoria. Ese envenenamiento se denominó berilosis.
Era por lo tanto fundamental encontrar el por qué era tan venenoso y como
se podía solucionar este hecho.
La berilosis se adquiere ya con
concentraciones en el aire superiores a los cien microgramos por metro cúbico
y durante décadas fue confundida con ciertos tipos de tuberculosis pues
su sintomatología era similar. Sería en 1946 cuando con una prueba de rayos
X se comprobó que los pulmones atacados presentaban
una apariencia granular difusa semejante a la que se produce en la
silicosis de los mineros, causada por la acción de los iones Be2+.
Estos iones interaccionan de forma parecida a como lo hacían en el caso
de interpretar el sabor dulce, esto es formando puentes de hidrógeno con
los OH de los núcleos bencénicos de determinados aminoácidos como la tirosina.
Dado que este aminoácido es una de las bases de muchos enzimas, este ión
va a aparecer en muchos de ellos compitiendo con el Mg2+ en centros
enzimáticos de las fosfoglucosomutasas, por lo que no actúa sólo en los
pulmones como se creía, sino en todo el organismo. Normalmente los tejidos
pulmonares contienen casi un microgramo de Be2+, que se puede
incrementar según las actividades desarrolladas por el individuo, ya que
abunda en el mantillo y en las cenizas de la paja de trigo. Su peligrosidad
es tan grande que sólo se permiten dos microgramos del ión por metro cúbico,
frente a los 100-500 mg/m3 de otros iones inorgánicos venenosos
como los de plomo, mercurio y arsénico.
¿Cómo se resuelve su intoxicación?
Vamos a justificar un tratamiento
inorgánico dado que se trata de un ión
inorgánico inmerso en una estructura orgánica: el cuerpo humano. Debemos
captarlo selectivamente haciéndolo insoluble para que pueda ser excretado
sin que dañe a los tejidos por los que pase. Se necesita por lo tanto un
reactivo analítico acomplejante, tolerado por el organismo, que no elimine
al Mg2+ necesario para la función enzimática. Este reactivo es
el ácido aurintricarboxílico (ATA) que no tiene nada que ver con el oro
y se denomina así sólo por el color
de sus combinaciones. Se trata de una alizarina similar a las empleadas
como indicador de pH. El compuesto dispone hacia el Be2+, una
termina acídica y un grupo hidroxilo próximo que lo toman como una pinza
(forma un quelato), en un plan o, mientras que en otro perpendicular, lo
engancha otra molécula de ATA. De esta forma nuestro ión aloja en orbitales
sp3 tetraédricos los pares electrónicos del reactivo que lo extrae
selectivamente, como si de una pinza se tratara. Y lo más importante, el
ATA es perfectamente tolerado por los pacientes.
[1]
Existen gran
tipo de moléculas con carácter dulce aparte de los azúcares. Incluso
no todos los azúcares son dulces. Por ejemplo aquellos que producen enlaces
intramoleculares como la beta manosa, son amargos. En las sacarinas el
puente de hidrógeno se da entre el oxígeno de un grupo sulfónico y el
hidrógeno de una imina. En los ciclamatos tan empleados en las bebidas
efervescentes, entre el hidrógeno de amina sulfonada y el oxígeno de ese
grupo. También el cloroformo tiene sabor dulce, sin embargo el ácido pícrico
y las sales de cesio son amargas, mientras que muchos iones salinos en
concentraciones muy pequeñas producen sensación dulce.
[2]
Existen muchas moléculas con sabor dulce, aparte
de los azúcares. En la sacarinas, el puente de
hidrógeno se da entre el oxígeno de un grupo benzosulfónico y el hidrógeno
de una imina, a 3D. En los ciclamatos,
tan empleados en las bebidas efervescentes, entre el hidrógeno de amina
sulfonada, y el oxígeno de este grupo. También el cloroformo tiene sabor
dulce; la distancia entre el Cl y el H, es de 3D. En nuestro caso, el efecto
polarizante del ion berilio sobre el par de electrones no ligantes del
nitrógeno proteínico, le hace cambiar de posición, provocando la activación
de la enzima adenilatociclasa, que comienza a sintetizar AMP cíclico,
que bloqua el paso de los iones potasio a través de la membrana. Al no
entrar los iones K+ y salir los sodio Na+, se
modifica el potencial eléctrico de la célula, trasmitiéndose la
descarga al cerebro que interpreta
así, el hecho.
[3]
En el caso del sabor ácido, incluso la corriente
protónica puede llegar a las células del sabor a rtravés de un efecto
túnel, despolarizándolas y generando la señal de transducción. En el salado,
los iones sodio despolarizan directamente los canales de sodio de la punta
de la membrana
[4]
El adenilatociclasa tiene especial relevancia
en las células receptoras del olfato, ya que su acción infiere en la creación
de estímulos diferentes para que el cerebro distinta los olores.
[5]
En el cierre de los canales de potasio también
pueden intervenir otros compuestos, como el trifosfato de inositol que
estimula la producción de ión calcio que es el que modifica la polarización
celular
[6]
Realmente se trata de hexasilicatos de fórmula
Si6O18 12-
[7]
El radio iónico del Al3+ es de 0,50D , mientras que el del Be2+ es de 0,31D
[8]
Cuando en 1930, Bothe y Becker en Berlín sometieron
al berilio a radiación alfa, la emisión altamente energética producida
(neutrones), fue llamada inicialmente
“rayos de berilio”.
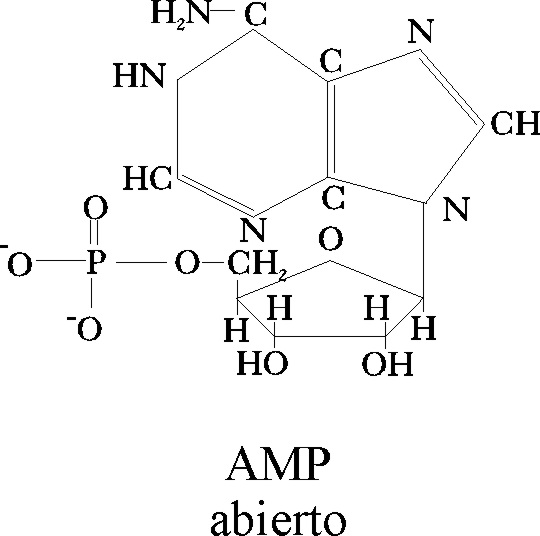
Fig.9