Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
DESDE EL COSMOS HASTA NUESTROS
SENTIDOS, LA CURIOSA HISTORIA DE UN ELEMENTO EXTRAÑO: EL BERILIO (continuación)
El Berilio y la química de la visión del color
En nuestro viaje interior, del
Cosmos, a la Tierra, y de ésta al Hombre, a través de nuestros sentidos, hemos
llegado justamente a la parte más difícil y más desconocida; la parte humana.
)Como captamos el color verde o
el azul?
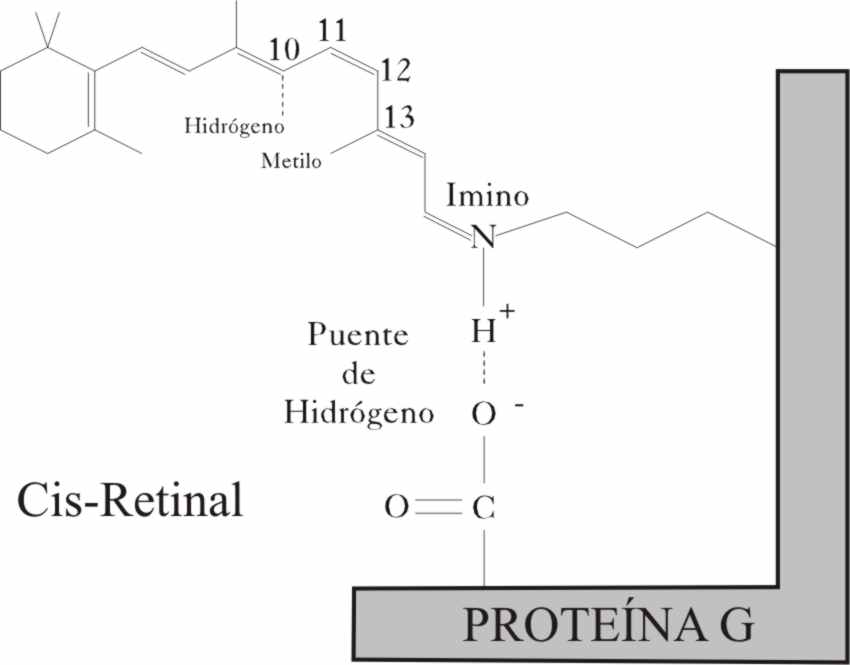
Cuando un fotón con esta energía, llega a nuestros ojos, y penetra hasta nuestra retina, alcanza en su fondo una determinada membrana con unas células en forma cónica, y denominadas por ello conos. Allí un determinado compuesto químico, el conocido cis retinal, la absorbe, con lo cual vence una barrera rotacional que le impedía tomar la configuración trans, según la reacción química:cis-retinal + hn = trans-retinal
Pero los hechos no son tan fáciles, ya que esta reacción desencadenará una serie de acontecimientos curiosos.
Veamos por
qué.

Fig.1
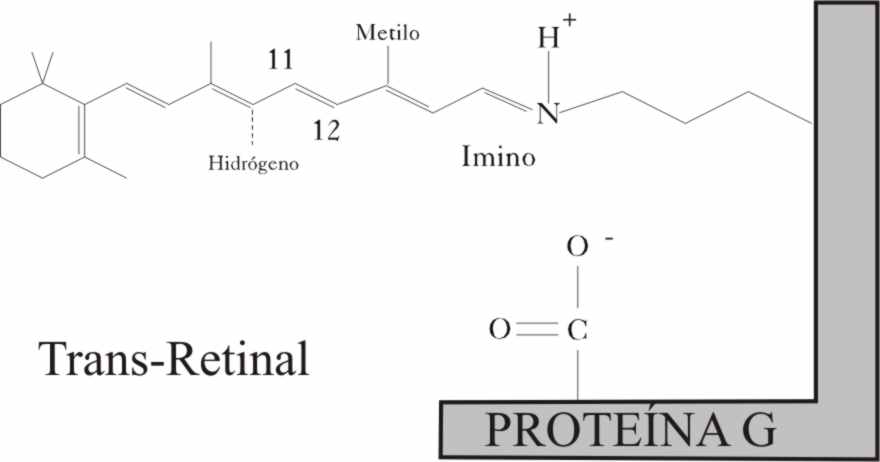
Fig.2
Como vemos no sólo se rompe una
interacción por puente de hidrógeno, sino que
la situación de los carbonos 10,11, 12 y 13 ha variado (fig.3)
El doble enlace entre el C-11 y
C-12, implica que los carbonos estén en hibridación sp2, y la superposición
π, impide el giro. Para que pueda hacerlo, deberá absorber la energía
necesaria para romper el enlace π .
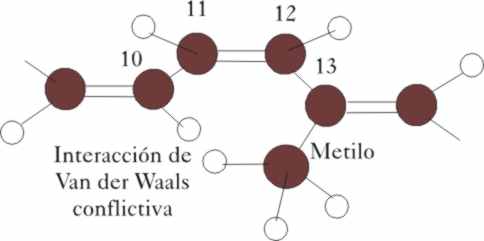
Fig.3
Ahora bien, el cis retinal, como
se ha mencionado, no está sólo, sino unido formando una base de Schiff, al
grupo imino de un tipo de proteínas
denominadas G, por portar el grupo de aminoácido guanidil. El cis retinal
excitado comienza a oscilar y a rotar, y este hecho da lugar a una serie de
movimientos conformacionales que mejoran el espacio entre el H del C-10, y
un grupo metilo del C-13, muy próximos en la forma cis, y en disposición eclipsada
o sin-periplana, lo cual justifica la
rapidez con que se produce el cambio de conformación, así como el excelente
rendimiento cuántico del proceso; cerca del 67%. Ahora bien, la estructura de la proteína, hace que uno de sus terminales acídicos, forme un puente
de hidrógeno con el H+, del grupo imino. Por ello cualquier giro
o cambio de conformación en el cis
retinal, provocará una disposición diferente de la proteína, tipo opsina.
La barrera torsional que implica
el cambio de estructura, es diferente según el grado de protonación de la
reacción, debido a que la presencia de H+, modifica el puente de
hidrógeno. Por ello, aunque a determinada concentración necesita un máximo de energía libre de 10 kcal/mol, sin
contar con el carácter endergónico de la reacción, que supone otras 35 kcal/mol, puede variar según se aprecia en
la gráfica (fig.4).
En muchos casos la barrera torsional alcanza
las 45 kcal/mol, pero la energía de
activación de Arrhenius, oscila entre 20 y 36 kcal/mol.
Es curioso que las oscilaciones
a 60 cm-1, son las que originan una mejor torsión del esqueleto
carbonado, y por otra parte es muy importante para la distinción de los colores,
ya que el ángulo de torsión está en función de la longitud de onda recibida,
así por ejemplo, la absorción en los 550 nm, tiene lugar especialmente cuando
la torsión es de 1801.
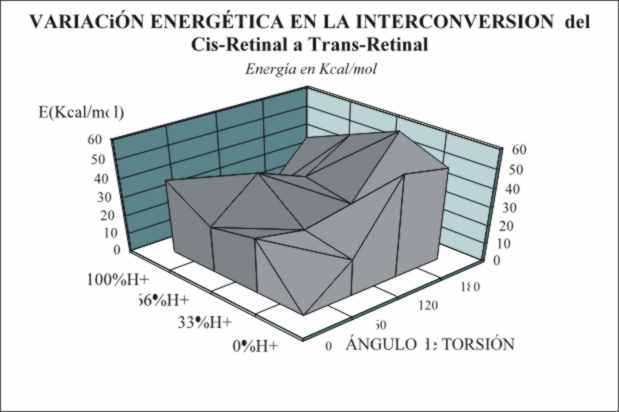
Fig.4
Las proteínas G que afectan a nuestro
sentido de reconocimiento del color, constan de 3 pigmentos, el verde, el
rojo y el azul, llamados así por ser sensibles específicamente a estas frecuencias.
El azul absorbe especialmente en 430nm, el verde en 530nm y el rojo en 560nm.
[2]
Estos pigmentos
se parecen bastante al rojo existente en los bastoncillos retinales;
la rodopsina. Sin embargo mientras la membrana que contiene a los bastones
que portan el pigmento rojo o rodopsina, está formada por discos, o láminas
delgadas, la que soporta los conos, sensibles al color, es bastante ancha
formando complejos pliegues, que hacen a veces de membrana superficial a
través de la cual se va a canalizar la acción eléctrica.
El cis retinal, está unido a las
proteínas G, que soportan los pigmentos visuales siempre por una lisina. Todas
constan de cadenas heptahelicoidales, y realmente les sienta mal el cambio
de configuración del cis retinal, al isomerizarse a la forma trans, más longitudinal.
Dicho cambio se efectúa en 200 femtosegundos, y al alejar el hidrógeno del grupo imino, rompe el enlace de hidrógeno con el grupo acídico de la proteína, activándose, lo que a su vez provoca su separación del retinal.
Podremos estudiar las 4 fases que se van a desarrollar, en la
isomerización y sus consecuencias, con el convenio de dibujos que se da en
la fig 5, en el cual los círculos negros, hacen referencia según su diámetro
a los estados trifosfato, difosfato o fosfato,
responsables de la adecuación en la transmisión energética.
El estado inicial, en una visión de conjunto,
contempla a nuestro cis retinal unido
a la proteína G por el puente de hidrógeno, situado en un pliegue de la membrana
ocular muy próximo a otra proteína G, la transducina T. (fig.6, y 7) Hemos
dichos que al romperse el puente de hidrógeno, debido a la vibración torsional
en el camino de la isomerización, se produce un desequilibrio arquitectónico, actuando la proteína G soporte del pigmento,
sobre una transducina T, que se encuentra muy próxima (Fase 1) (fig.8 y 9).
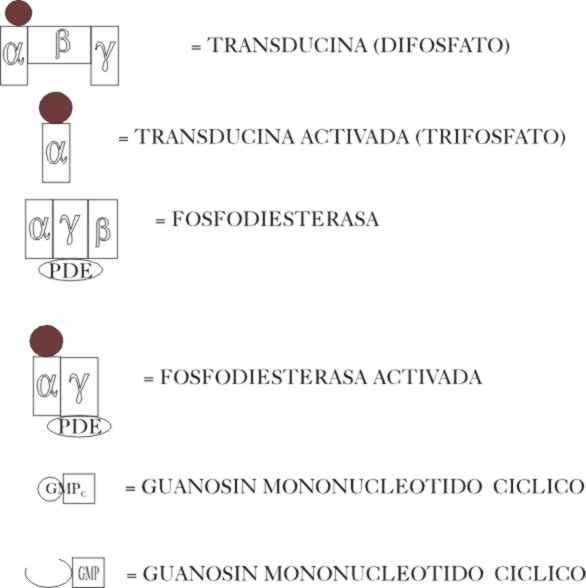
Fig.5
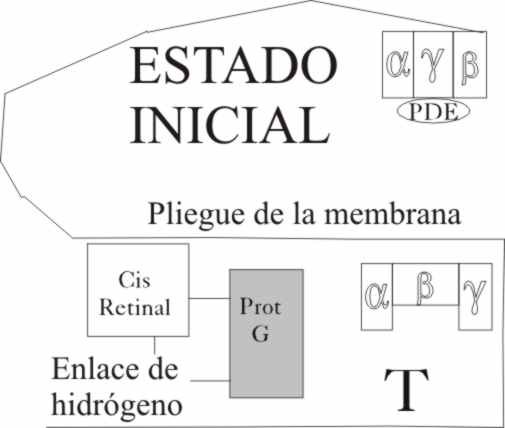
Fig.6
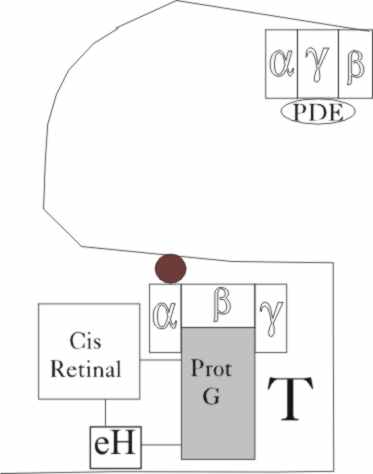
Fig.7
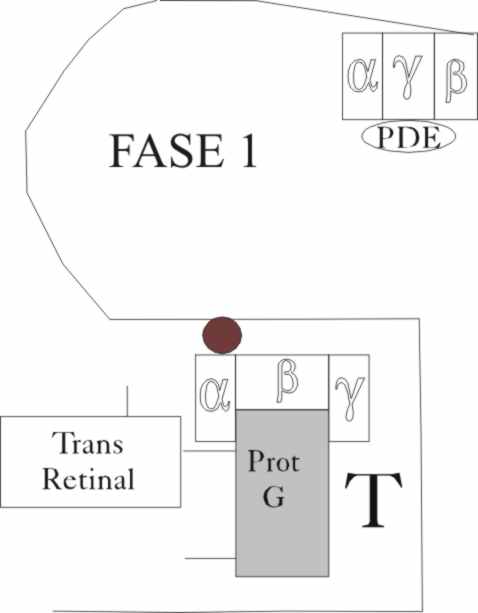
Fig.8
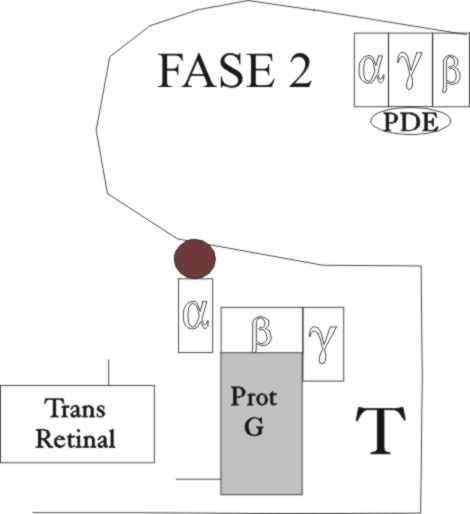
Fig.9
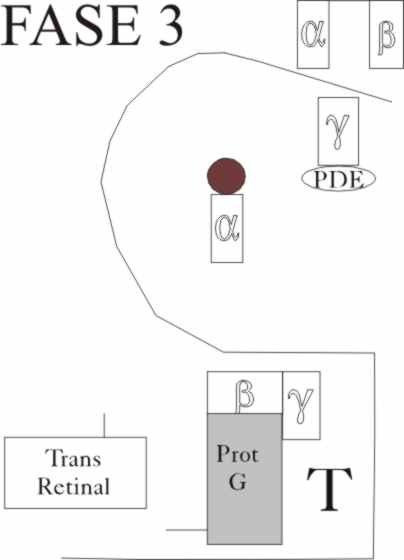
Fig.10
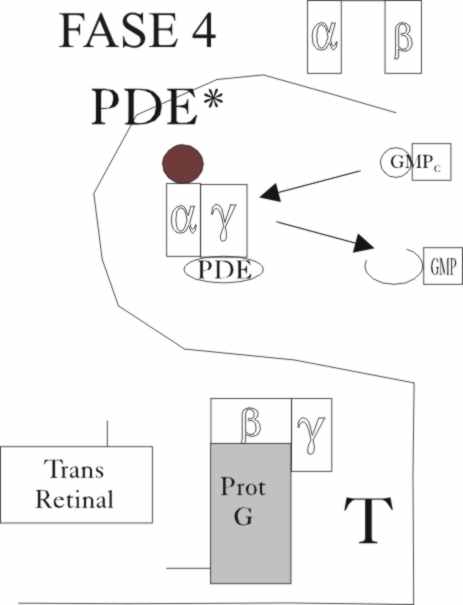
Fig.11
El trasvase energético procedente
de la proteína G activada, hace que a su vez se rompa la trasducina alfa,
sintetizando GTP, a partir del GDP (Fase 2). El nuevo enlace P-O formado,
emplea la energía surgida (12kcal/mol por enlace) por transmisión de las formas
activadas, pero al no caber en el sitio que tenía, provoca la rotura de las
cadenas alfa y beta de la proteína portadora. La activación de cientos de
moléculas de transducina, por una simple proteína G portadora de pigmento
activada, constituye el primer paso de la amplificación de señal en la visión.
Este hecho a su vez activa una enzima, la fosfodiesterasa, PDE*, que estimula
a nuestro protagonista, el GMPc, el nucleótido guanidil monofosfato cíclico,
que abre su ciclo, volviendo a formarse el GDP
[4]
. La fosofodiesterasa, consta también de tres cadenas
α, β y γ, de 88kDa, 85kDa y 9 kDa respectivamente. La transducina,
activa a la fosfodiestera, al disociarla,
separando las unidades α y β
que la inhiben. De esta forma la fosdiesterasa es capaz de hidrolizar el GMPcíclico,
en sólo 0,6 ms. Como puede apreciarse la cadena de acontecimientos que supone
la absorción de fotones de una determinada energía, es realmente complicada(
fig.10 y 11). Pero esa complicación ejerce un efecto multiplicador, aumentando
el rendimiento fotónico y de esta forma una serie de cuantos energéticos es
suficiente para abrir más de cuatro mil moléculas de GMP cíclico.
La diferente absorción de energía, según la frecuencia de la luz, produce excitaciones distintas, y que son absorbidas por las tres proteínas G, cada una con su pigmento específico.
La transducina, es una proteína también del
tipo G, formada por 3 cadenas, α, β y γ, portando la primera un grupo GDP (difosfato de guanosina).
La diferencia entre ellas es pequeña
pero suficiente. Es evidente que estas pequeñas diferencias entre los pigmentos indican un origen
común codificado por el cromosoma X; la evolución durante 500 millones de
años, las creó. Todos ellos mantienen un 45% de sus aminoácidos idénticos.
Los más parecidos entre sí, son
el roja y el verde (96%), mientras que referidas a la rodopsina (pigmento
de los bastoncillos), coinciden en un 75% aproximadamente. Este hecho, marca
la pequeña diferencia entre la absorción 530nm para el verde y 560nm para
el rojo (fig.12). Sin embargo como el problema de la diferente absorción,
es fundamentalmente conformacional, la sustitución simple de un aminoácido
con ramificaciones o con grupos polarizantes, frente a otro que no los tenga
así ya implica una diferencia en dicha capacidad.
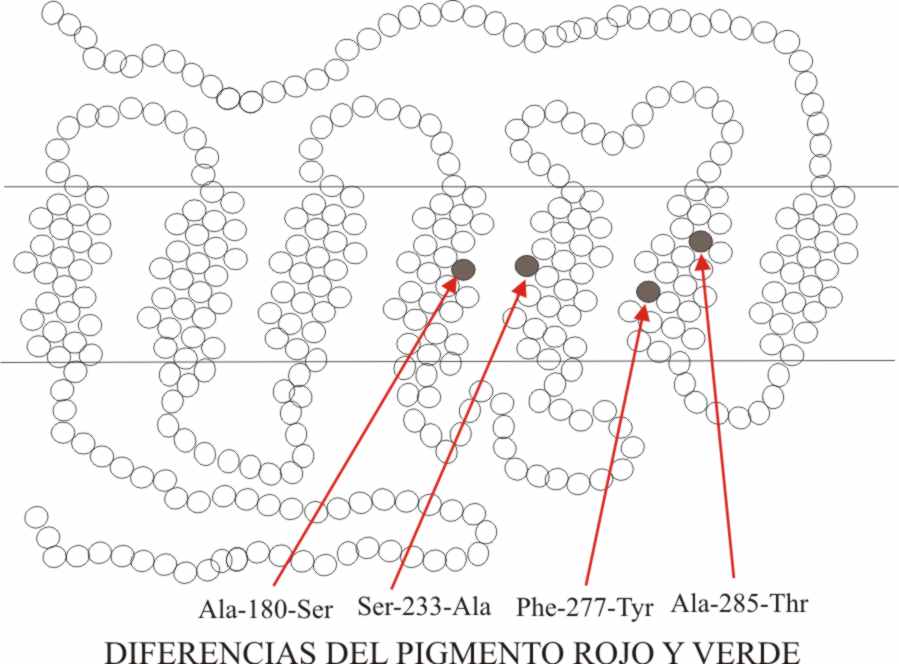
Fig.12
Así tenemos que la sustitución
de una serina por una alanina en la posición 180, provoca una variación en
la absorción de 4,8nm.
Exactamente podríamos decir lo mismo en la sustitución
en la posición 277, de una fenilalanina (Phe) por tirosina (Ty). Podemos observar
en el dibujo las diferentes sustituciones
de aminoácidos que determinan las diferencias entre el pigmento verde y el
rojo (fig.13).
La mayor parte de estas sustituciones, consisten en reemplazar
aminoácidos con hidroxilo, tal como la tirosina por fenilalanina; la clave
está en que el momento dipolar intrínseco de la tirosina, produce la perturbación
electrostática suficiente para condicionar la absorción energética.
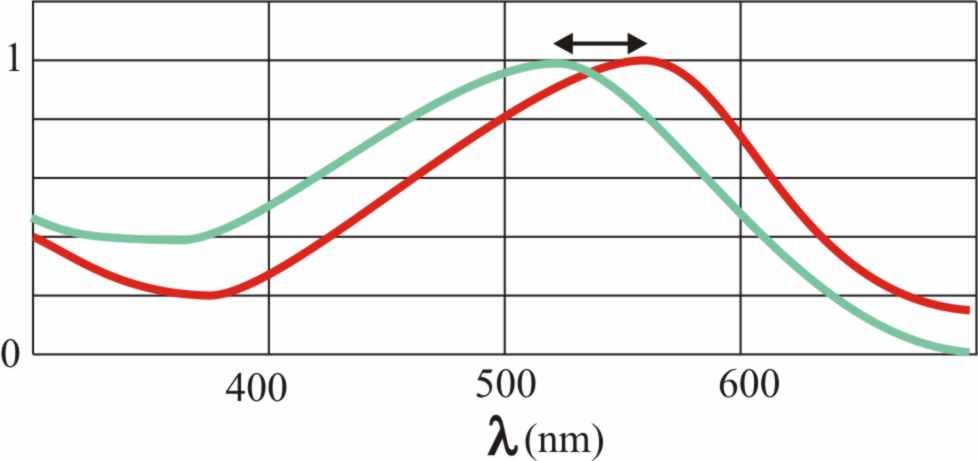
Fig.13
En los dibujos (fig.12 y 13) no sólo se puede
comprobar la variación de la absorción con la sustitución de los aminoácidos
indicados, sino también la pequeña diferencia que existe entre los pigmentos
verde y rojo (sólo los aminoácidos representados por círculos en negro). Desde
el punto de vista energético, esta diferencia implica únicamente una absorción
de energía de 3 kcal/mol. En cambio existe
una mayor diferencia entre el pigmento azul y los otros dos, no solamente
en los aminoácidos, sino incluso en la forma y estructura, como se aprecia
en la fig.14
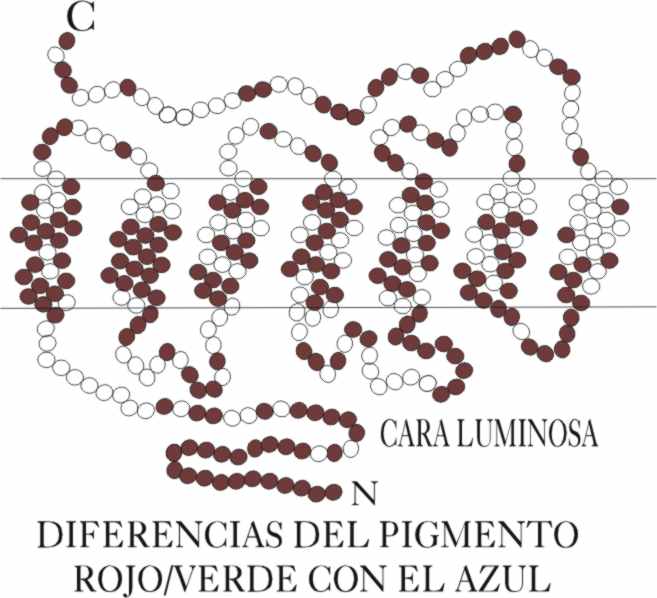
Fig.14
Estas diferencias, motivan que
la carga total del pigmento sea diferente. Así la del pigmento azul es +1,
la de la rodopsina de los bastoncillos, 0 y la del pigmento verde-rojo,
-1. Pues bien, ahí está la otra clave de las distintas absorciones.
Cuando el cis retinal se excita,
trasmite la carga positiva desde la base de Schiff, al sistema conjugado
de electrones π, y los aminoácidos cargados positiva o negativamente,
próximos a la base de Schiff estabilizan
o desestabilizan el sistema. Por eso como veremos, la parte diferenciante de los dos pigmentos, el azul y el rojo-verde,
está justo en dicha zona.
Curiosamente esta alteración en
algunos aminoácidos, producida genéticamente, a partir de la codificación
del ADN, es la que provocará la indiferenciación de los colores, característica
del daltonismo
[5]
. John Dalton, creía que su incapacidad para diferenciar
determinados colores; confundía el escarlata con el verde y el rosa con
el azul, se debía a que su humor vítreo estaba teñido de azul, por eso en
su testamento dejó indicado que un médico le hiciera la autopsia, para verificarlo.
Sin embargo, Joseph Ransome, el médico en cuestión, no encontró nada anómalo.
Dalton murió el 27 de julio de 1844, y 150 años después se estudia en profundidad
lo que le ocurría, a través del análisis de su DNA.
El daltonismo se conocía desde
mucho antes que Dalton, como se ha indicado
[6]
.Young, en 1807, suponía que se originaba por la
Aparálisis de algunas fibras de
la retina@. El problema de Dalton se creyó
originado por un defecto cerebral. Actualmente se conoce como protanopia o deuteranopia, se origina por
la falta del pigmento visual rojo (LW) o verde (MW), asociadas a los cambios
de genes en los cromosomas X. Los genes que codifican los pigmentos verde y rojo tienen seis regiones
de codificación o exones, los cambios se generan por entrecruzamientos anormales,
debido a interacciones no previstas en cambios conformacionales.
Hemos visto que la diferencia entre
los dos pigmentos cuya ausencia es responsable del daltonismo, es únicamente
en 15 aminoácidos. Las diferentes sustituciones en estos últimos, hacen
que uno de los dos se pueda prácticamente convertir en el otro, produciendo
la ausencia o falta de uno de los dos pigmentos. En los conos retinales
de Dalton sólo había pigmento azul y verde; faltaba el rojo, por eso padecía protanopia.
)Cómo se puede identificar este
hecho? Simplemente recordando las propias palabras
de Dalton, cuando describe el espectro solar: A... la parte del espectro que se
conoce como rojo, me parece tan sólo como si fuera una sombra@.
Ya se ha absorbido la diferente
energía, que se ha trasmitido a través de la diferente excitación de la proteína
G, ya se ha activado la difosfoesterasa, y por fin se ha abierto el GMP cíclico
(fig.15), por hidrólisis (fig.16), según
el esquema dado (en el cual las especies con asterisco suponen moléculas activadas),
que resume todo lo dicho anteriormente. La enorme importancia y trascendencia
de este compuesto cíclico está en que actúa de portero en los canales de la bomba
de sodio- potasio, responsable de transmitir los impulsos eléctricos al cerebro.
La unión de 3 o más moléculas de GMP cíclico basta para abrir un poro, o puerta
de la membrana.
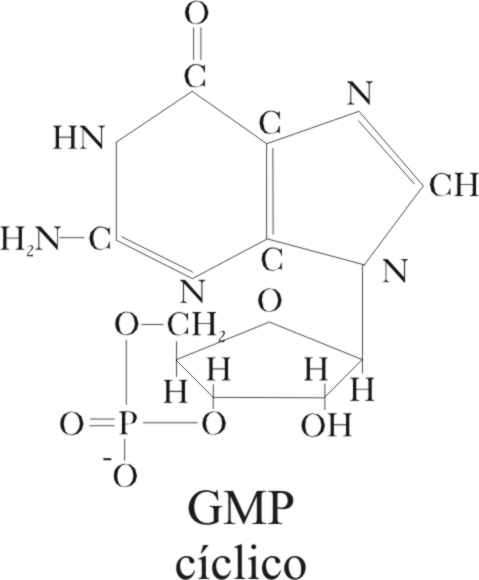
Fig.15
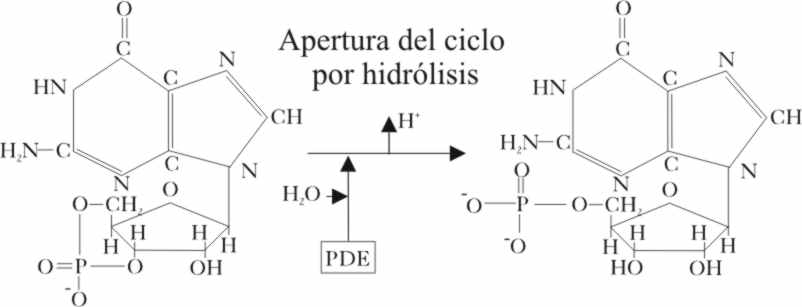
Fig.16
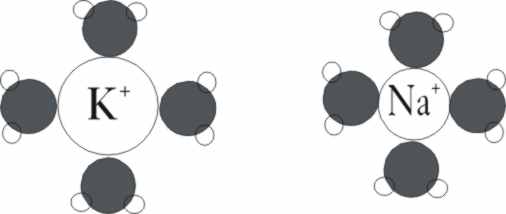
Fig.17
La membrana de una célula visual,
separa dos medios con diferentes concentraciones iónicas. En la parte externa
la concentración de iones sodio es grande y la de potasio pequeña, mientras
que dentro de la célula ocurre lo contrario. Las puertas de acceso son poros,
de diferente tamaño, adecuados al tamaño de los iones que deben pasar por
ellos. El ión Na+, tiene un radio iónico de 0,95D, mientras que el K+, es de 1,34D, pero al estar ambos hidratados, su volumen
es mucho mayor (fig 17).
La puerta del sodio tiene una superficie
de 5 x 3D, que no permite la entrada de
las moléculas de agua, que deberán perderse antes. Ya una vez dentro del poro,
los terminales acídicos COO- , de las proteínas que forman el conducto,
ayudan a los iones Na+ a penetrar.
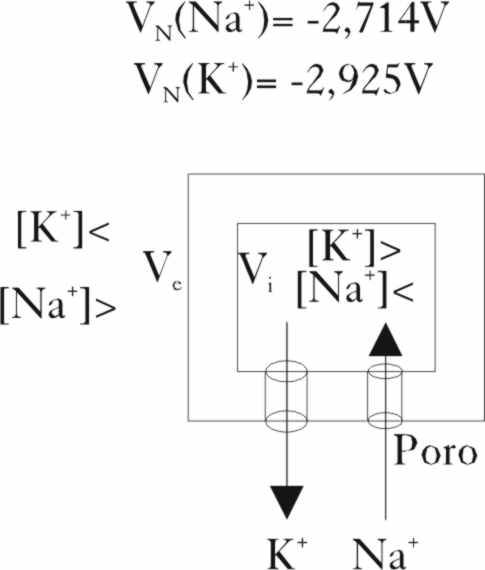
Fig.18
El número de canales de sodio es diez veces mayor que el de potasio, y los K+, no pueden obviamente pasar por la puerta del sodio. Dado que normalmente entran iones potasio por su puerta y salen iones sodio y como el potencial redox de ambos iones es diferente, que según la ley de Nernst, varía con la concentración, la diferencia de potencial entre V exterior (Ve) y V interior (Vi) a través de la membrana es de -0,1V (fig.18).
)Qué acción desempeña el GMP cíclico
y qué ocurre cuando se abre el ciclo?.
En la oscuridad, la concentración de GMPcíclico
es grande, y agrupándose de tres en tres, abren los poros de la membrana,
impidiendo que otros grupos los cierren, y ayudan a limpiar del agua de hidratación,
a los iones sodio para que así puedan entrar libremente y sin dificultad (fig.19),
produciéndose la llamada corriente oscura que va a generar una diferencia
de potencial de membrana de hasta -0,40V (fig.20).
La forma cíclica en la responsable, pues la molécula al ciclar es más
pequeña, y los grupos activos acídicos del fosfórico están anulados.
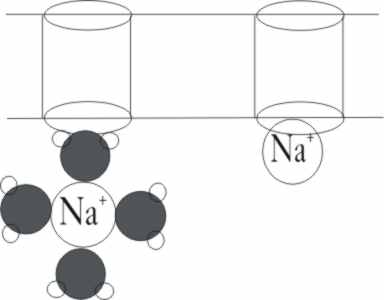
Fig.19
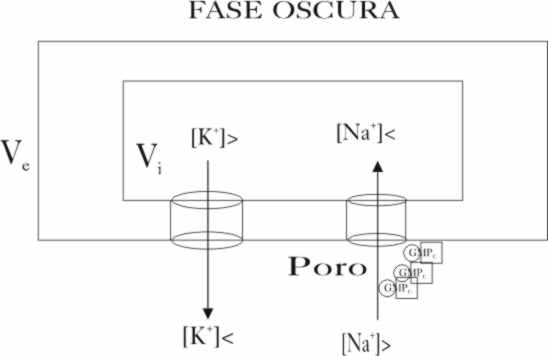
Fig.20
Al recibir fotones de determinadas longitudes
de onda, a través de la activación explicada, disminuye la concentración de
GMP cíclico. Al abrirse el ciclo justo por el grupo fosfórico, los terminales
acídicos con carga, no sólo ocupan unidireccionalmente mayor espacio, sino
que al tener carga, interfieren mucho más con los iones solvatados. Los grupos
O-, tienen una especial afinidad por los
iones positivos, en este caso Na+, con lo cual disminuye
su concentración, impidiéndoles pasar (fig.21 y 22). De esta manera, al disminuir la concentración
de sodio, la diferencia de potencial negativa va aumentando desde -0,4V hasta
-0,7V llegando a un punto que se produce
la descarga, trasmitida por los canales iónicos hasta el cerebro, que la traduce
y lee en su lenguaje binario, registrándola
como un determinado color. La intensidad
de corriente producida es 100 veces menor que la que obtiene en los bastoncillos,
por eso necesitamos una buena iluminación para distinguir los colores
[7]
.
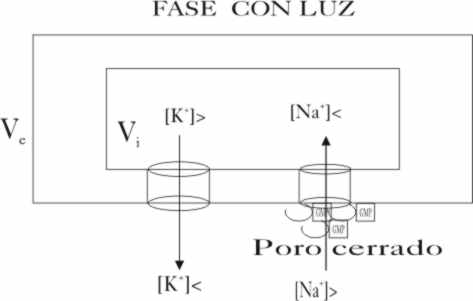 Fig.21
Fig.21
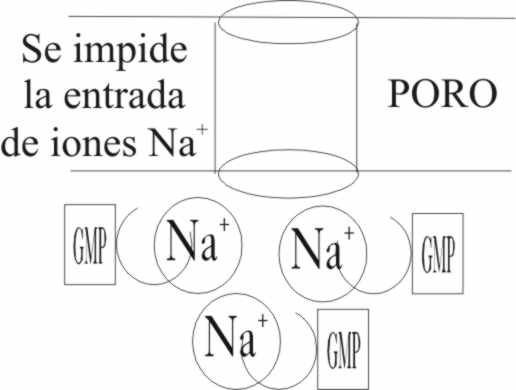
Fig.22
No debemos olvidar que la absorción aunque lo
hace a través de los conos, de forma
independiente de la longitud de onda incidente, la excitación de las proteínas
G es diferente, la energía multiplicada y liberada también lo es, así como
el número de moléculas cíclicas de GMP abiertas, y por lo tanto el número
de poros cerrados, produciéndose descargas distintas.
En la interconversión del guanilato
cíclico, interviene también indirectamente el ión Ca2+. La disminución
de de su concentración, estimula la síntesis del GMPc y su afinidad
por el poro. De forma que una baja concentración de aquel ión reabre los
canales activados.
La corriente eléctrica, que se produce la visión en color, para un fotón, a través de los conos, es muy pequeña, a diferencia de la que se produce a través de los bastoncillos (no se distingue el color). Así, para un sólo fotón, es irregistrable pues se estima en un valor de 10 femtoamperios (10.10-15A), sin embargo en los bastoncillos era de entre 1 y 2 pA.
)Por qué el berilio brillaba?
El Berilo, que da nombre al BERILLIUM,
realmente es un silicato de berilio y aluminio, con una estructura en capas.
Las capas de silicatos
[9]
dejan una serie de huecos que serán ocupados por
los iones Al3+ y Be2+, los primeros en huecos octaédricos
(tienen mayor volumen)
[10]
, y los segundos en huecos tetraédricos. Estos iones
así dispuestos, en los huecos de las cadenas son los responsables de las
propiedades que le otorgaron el título de piedra preciosa pues estos metales
aumentan el índice de refracción del vidrio, tal como los iones Plomo que
se usan en las mejores fábricas de cristal europeas, con lo cual y de forma
natural los cristales del silicato adquieren propiedades semejantes a los
brillantes, pues la luz parece atrapada en ellos, ya que debido al elevado
valor de aquél, en seguida se alcanza el ángulo límite reflejándose hacia
dentro. Los iones Be2+, estimulaban el brillo, y de esa manera
se mezclaron con el fósforo para acentuar la fosforescencia de los tubos
recubiertos de fosfatos de berilio, hasta que a partir de 1940, comenzaron
o observarse unas inexplicables muertes de obreros que había estado implicados
en el proceso de fabricación de dichos tubos.
[1]
La fóvea humana, el punto de fijación en el
centro del campo de visión es un círculo de 0,3mm de diámetro. En él hay
10.000 conos y ningún bastoncillo. Los conos distan unos de otros de 2
a 5 micrones y sus conexiones nerviosas con las células ganglionares tienen
muy poca convergencia. A esto se debe la gran agudeza ya que el estímulo
de los conos adyacentes produce la actividad de dos fibras diferentes
del nervio óptico. La densidad de conos disminuye uniformemente hacia
la periferia.
[2]
La existencia de estos pigmentos, era conocida
desde 1781, cuando el médico alemán Giros von Gentilly, supuso que existían
tres tipos de moléculas o membranas"
en la retina, correspondientes a las tres zonas de color. Recuérdese que
el daltonismo, explicado por Dalton, y referido a su incapacidad de reconocimiento
del color, en una sesión en la Sociedad Filosófica y Literaria de Mánchester,
celebrada en 31 de octubre de 1794.
[3]
El dalton es una unidad de masa atómica muy
empleada en bioquímica, que equivale a 1 u (unidad de masa atómica). Por
lo tanto 39 kd, equivale a 39000 u (peso molecular 39000)
[4]
El tránsito GTP a GDP y viceversa, forman el
intercambio energético necesario, para aportar la energía empleada en la hidrólisis y liberación de las moléculas
del nucleótido GMP cíclico, formado por ribosa, una base pirimidínica
como la adenosina del ADN, en este caso la guanidina, y el ortofosfato
formando un ciclo.
[5]
El término Daltonismo sólo existe en francés,
español y ruso; estos últimos lo tomaron de aquél. Fue usado por primera
vez en 1827, por P.Prevost.
[6]
Ya en 1785, el rey Jorge II I de Inglaterra,
en una carta escrita a Madame D=Arbey, hace referencia
a que el duque de Marlborough, no podía distinguir el rojo del verde,
y que dicho defecto era de origen hereditario.
[7]
El hecho es similar a lo que ocurre en la impresión
de la película fotográfica de color en la máquina de fotos. Si hay poca
luz, o no se ha abierto bien el diafragma, los colores se difuminan, mientras
que si la iluminación es correcta se aprecian mucho mejor.
[8]
La composición de rojo y verde produce
amarillo
[9]
Realmente se trata de hexasilicatos, de fórmula
Si6O18 12-
[10]
El radio iónico
del Al3+ es 0,50Å, mientras que el del Be2+ es 0,31Å