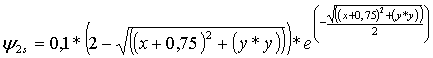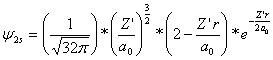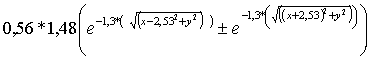ENSEÑANZA
DE LA FÍSICA Y LA QUÍMICA
sección:
TEMAS DE FÍSICA Y QUÍMICA
Orbitales moleculares II
Tópicos
en la descripción de OM
En “Orbitales
moleculares I”, se criticó la curiosa la descripción gráfica de los orbitales
moleculares (OM) en los textos en Enseñanzas Medias. Al aplicar el método
CLOA (combinación lineal de orbitales atómicos), siempre se tomaban los orbitales
atómicos hidrogenoides, aunque la molécula de hidrógeno no excitada no forme
enlaces con combinaciones lineales
superiores al 1s. Este era el primer tópico que surgía en los textos mientras
que el segundo era creer que los OM
moleculares del mismo tipo tienen la misma forma o son aparentemente iguales.
En este trabajo
vamos a comparar los OM F2s,
formados por combinaciones lineales de átomos no hidrogenoides comparados con los hidrogenoides (que aparecen
en los textos).
La función
de onda atómica R2s
general y aplicada a un hipotético átomo de hidrógeno
con los condicioantes de la carga nuclear efectiva Z’=1, y
en unidades bohr a0 =1 es:
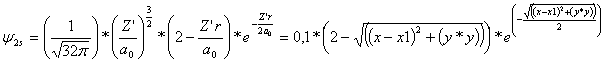
Por lo que aplicándolo a dos átomos de hidrógeno cuyas
funciones se sumarían o restarían y tomando una distancia de 1,5 radios de
bohr, sería:
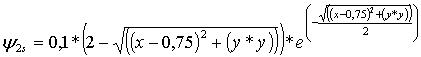 y
y
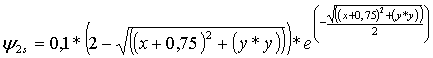
La combinación
lineal produciría los OM cuyas gráficas y curvas de nivel serían los dados
en las fig 1 y 2, en combinaciones enlazantes y 3 y 4, en antienlazantes.
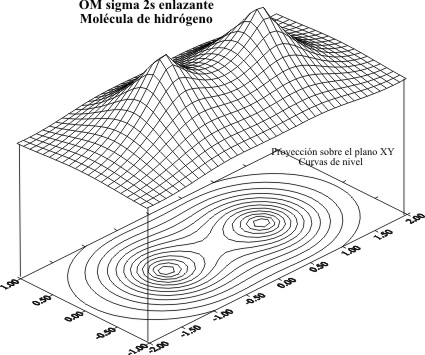
Fig.1
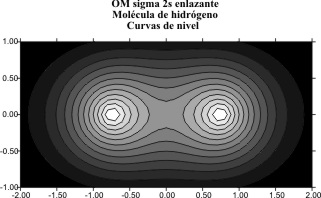
Fig.2
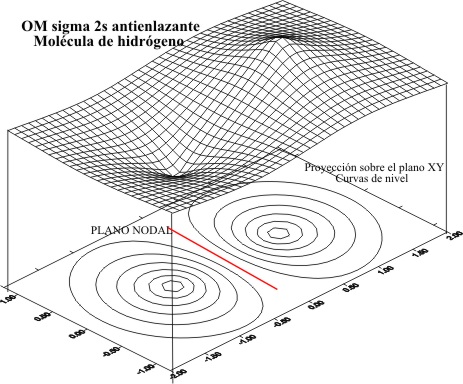
Fig.3
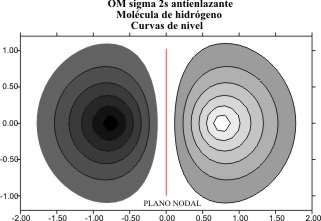
Fig.4
Sin
embargo esta misma combinación lieal, si cambiamos las condiciones de contorno,
extendiéndolas hasta los 10 bohr, como
se hará con la mayoría de los elementos
del segundo período, producirían unos gráficos muy diferentes como se vé en
las fig 5 y 6.
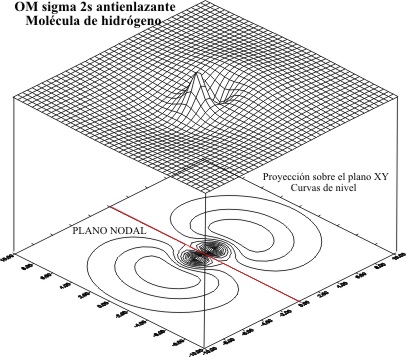
Fig.5
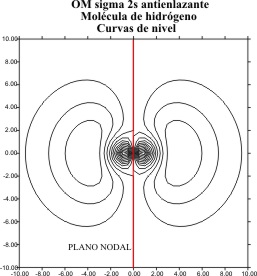
Fig.6
Al aplicarlo
a sucesivos elementos del segundo período
la expresión
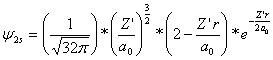 vendría modificada no sólo por
los valores de r ( la distancia de separación aumenta) sino sobre todo por los
de de Z’ (carga nuclear efectiva), con lo que la combinación lineal para el
Li2, de orbitales 2s, proporciona una función N2s:
vendría modificada no sólo por
los valores de r ( la distancia de separación aumenta) sino sobre todo por los
de de Z’ (carga nuclear efectiva), con lo que la combinación lineal para el
Li2, de orbitales 2s, proporciona una función N2s:
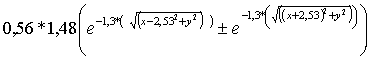
que representada nos da los gráficos
de las curvas de nivel del OM enlazante y antienlazante de las figuras 7 y
8
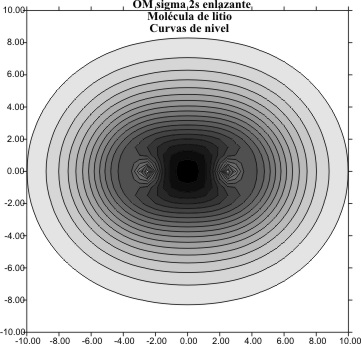
Fig.7
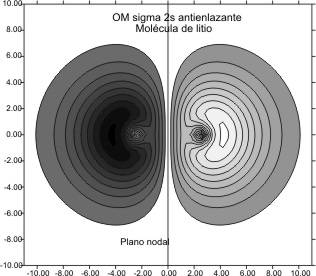
Fig.8
Si se eleva al cuadrado se obtendría la densidad
de probabilidad, que para el Li2 antienlazante se representaría
en la fig.9
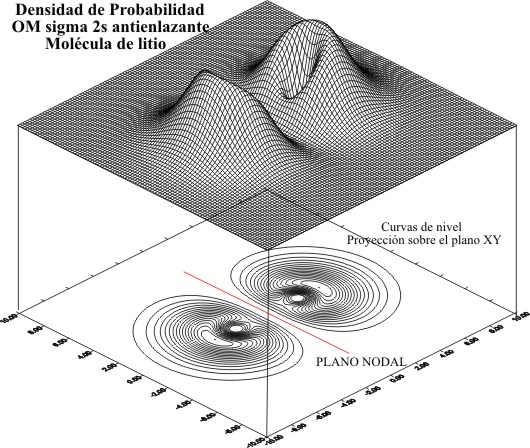
Fig.9
Como se observa los límites de la densidad de probabilidad
son inferiores a los del OM
Al trasladarnos hacia la derecha a través del sistema periódico a otros elementos
del segundo período, desde el litio hasta los correspondiente del oxígeno ( fig 10 y 11) y del flúor ( fig 12 y 13) percibiremos en los gráficos
de las curvas de nivel, la disminución del tamaño del OM F2s,. Esta disminución,
va de unos límites de "10 bohr en el F2s del
Li2 hasta los " 3 bohr para el
correspondiente del F2.
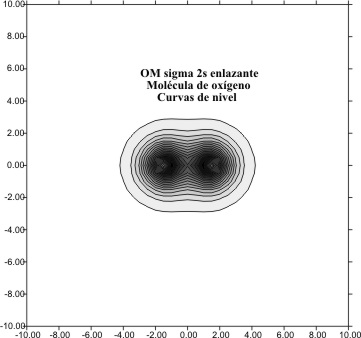
Fig.10
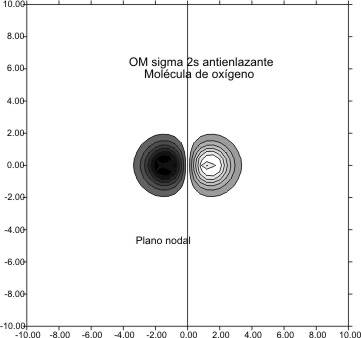
Fig.11
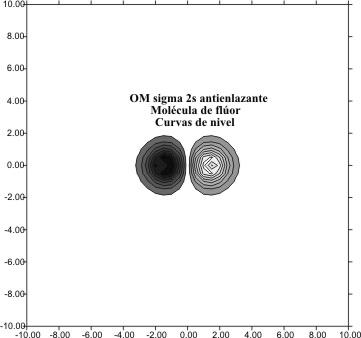
Fig.13
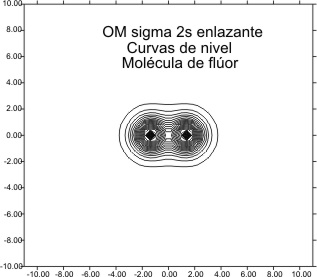
Fig.12
Como
es lógico esta disminución del tamaño todavía es mas acusada en las curvas de
densidad de probabilidad, para OM F2s del mismo tipo, como las de la hipotética
molécula de carbono (C2), y la de O2 (
fig 14 y 15)
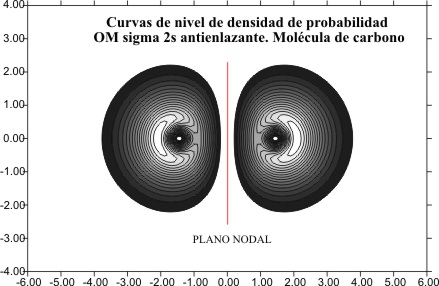
Fig.14
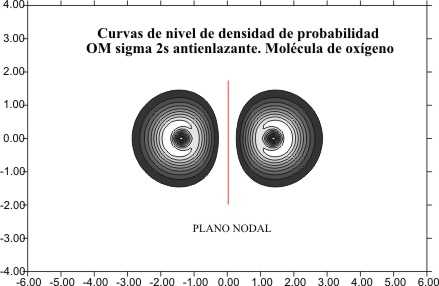
Fig.15
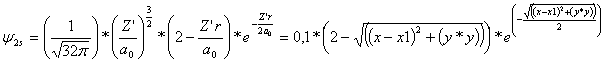
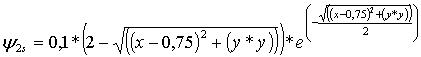 y
y