.jpg)
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
PROBLEMAS VISUALES DE QUÍMICA AGRUPADOS
PVQG35-1*
. Deshidratación del etanol
.jpg)
En la foto dada, se observa el calentamiento de 5ml de etanol 50% (densidad=0,91g/mL) con
un poco de sulfúrico concentrado en A. El gas producido se enturbia al
enfriarse en B, y se recoge sobre agua en C.
a)
Formula la reacción producida
b)
Si el rendimiento de la operación es del 10%,
(debido a que se forman otros productos) determina el volumen de gas a 20ºC, y 760mmHg.de
presión que se recoge en C
c)
Cuantos átomos del compuesto se recogen en C
DATOS:
Presión de vapor del agua a 20º, 17,5mmHg
Masas atómicas: C,12-H,1-O,16
N.Avogadro= 6,022.1023partículas/mol
PVQG35-2.**. Química del Tornillo

Foto 3

Foto 2

Foto 1
PVQG35-3.***. Isomería orgánica II
Se
dispone de 50mL de disolución 0,5M de sulfato de cobre (II) y un tornillo de
hierro de 4,12g (foto 1). Se sumerge el
tornillo en la disolución (foto 2), reaccionando ambos y recubriéndose el
tornillo de una capa de cobre (foto 3).
Al cabo de cierto tiempo se extrae el
tornillo, se seca y se pesa. Pesó 4,18g
a)
Formula las
reacciones que han tenido lugar
b)
A qué se deben
las burbujas de gas que se aprecian
c)
Determina la
concentración de la disolución final de sulfato de cobre(II)
DATOS
Potencial redox
Cu2+/Cu=-0,345
Fe2+/Fe=-0,44
Masas atómicas Cu=63,6 ; Fe =55,9 ¸ O=16 ,
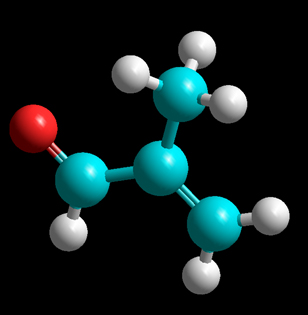
Isómero 2
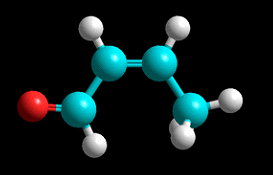
Isómero 1
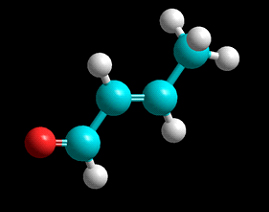
Isómero 3
Las tres fotografías son de modelos moleculares de varillas y esferas de isómeros de fórmula empírica C4H6O. En estos modelos los átomos de carbono son de color azul , los de hidrógeno blanco y el oxígeno, rojo.
a) Los isómeros 1 y 3, tienen una isomería geométrica que no presenta el 2 ¿Por qué? Nómbralos
b) El isómero 2, al adicionar HCl, formula la reacción ¿Qué compuesto forma?
c) A 20mL del isómero 3 (densidad 0,85g/mL), se le agrega 50mL de una disolución de agua de bromo rojiza al 2% (densidad 1,018g/mL), decolorándose después de agitación. Formula la reacción ¿Qué compuesto forma y en qué cantidad?
Masas atómicas C=12 ; H =1 ¸ O=16 , Br=79,9