ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
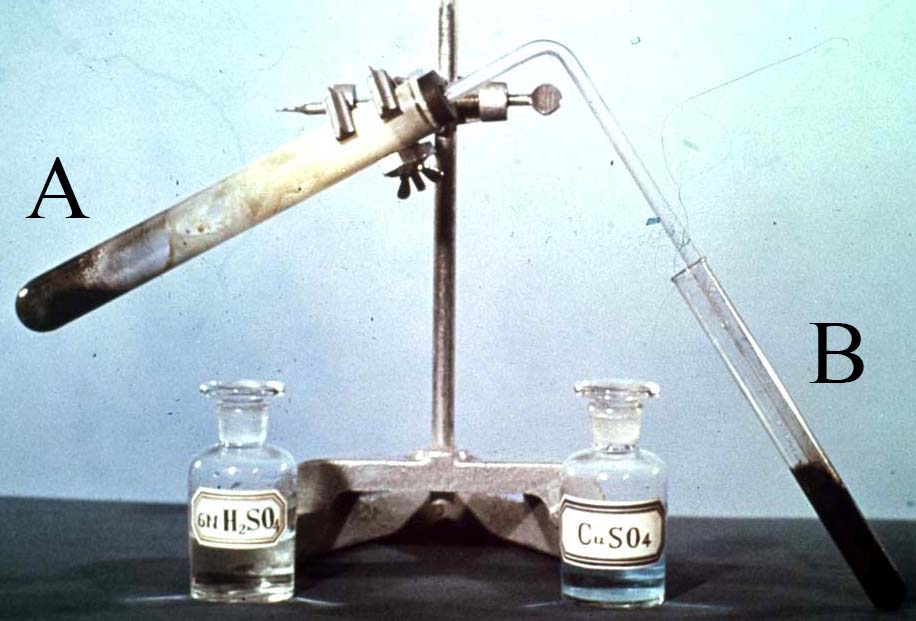
PVQG29-1.**. Mezcla de
Fe/S calentada, y tratada con ácido sulfúrico reaccionando sobre sulfato de
cobre(II)

En A se disponen 5,6 de Fe y 3,2g de azufre, y 10mL de ácido sulfúrico 6N,y en B, 30mL de disolución de sulfato de cobre 0,5M. La mezcla de azufre y hierro en las proporciones dadas, se calienta fuertemente. El ácido sulfúrico reacciona con los productos, produciendo un gas que burbujea en B, a consecuencia de él, se produce un precipitado de sulfuro de cobre en B.
a) Formula las reacciones producidas
b) Determina los gramos de precipitado de sulfuro de cobre que se producirán en B
OBSERVACIÓN. Se supone que reacciona completamente todo el gas producido.
DATOS:
Masa atómica del Fe 55,8g/mol. Masa atómica del Cu =63,6g/mol.Masa atómica del S =32,0g/mol
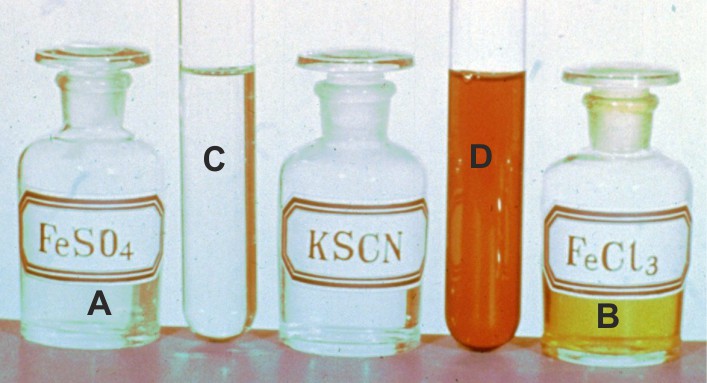
PVQG29-2*
Iones ferroso y férrico (III)
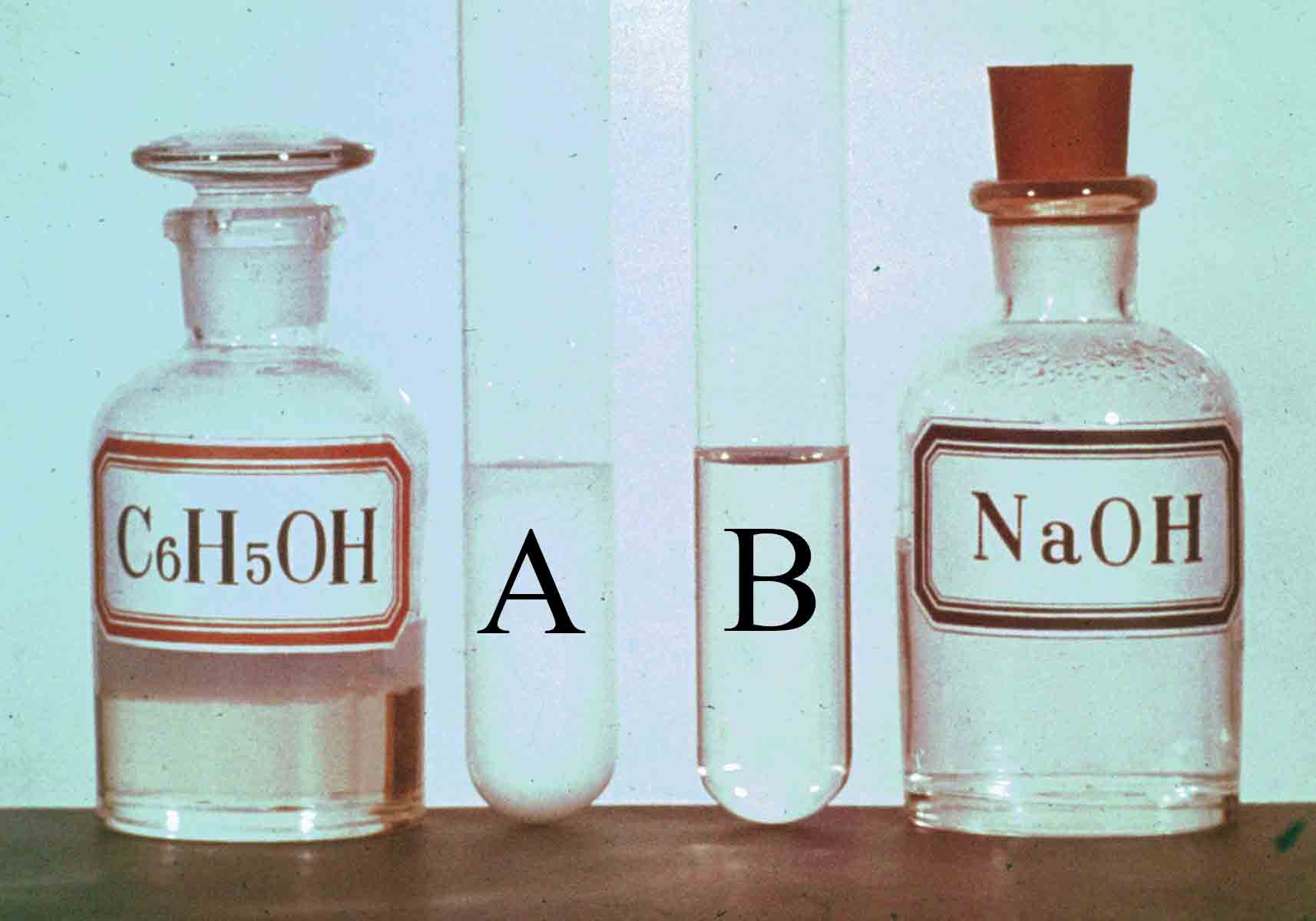
Dispones en C de 20mL de disolución de sulfato de hierro(II)
2M, de A a la que agregas una cantidad suficiente de tiocianato potásico e igual se hace en D, con 20 mL de cloruro de hierro(III) 2M, agregándose en todos
los casos agua destilada hasta completar 50mL
a)
Formula
las reacciones que tienen lugar en cada tubo.
b)
Cuál
será la concentración de in ferroso en C
c)
Cuál
será la concentración de ion férrico en D
PVQG29-3. Reacción del fenol*
El fenol se encuentra en forma de
agujas cristalinas incoloras, volviéndose rojizo con el tiempo a temperatura
ambiente. En A se disponen 40mL de fenol en agua (solubilidad en agua a 20ºC,
8g/100mL ), agregándosele 5 mL de hidróxido sódico 2N, con lo que se hace
soluble, como se ve en el tubo B.
a)
Formula
la reacción que da lugar a la
solubilización del fenol en hidróxido sódico. ¿Qué tipo de reacción es?
b)
Determina
la cantidad de fenolato sódico formado en estas
condiciones.
MASAS ATÓMICAS: C,12. O,16; H,1;
Na,23