ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
141*. Las primeras electrólisis fueran realizadas por el inglés Humphrey Davy, a principios del siglo XIX, tan pronto se desarrollaron las pilas de Volta, y se realizaron en sólidos fundidos. Para ello empleó potasa (KOH), que tenía un punto de fusión relativamente bajo, ligeramente humedecida para hacerla conductora, y conectada a una pila hecha con placas de cinc y cobre. Al poner un alambre de platino conectado al polo positivo se puso en contacto con la potasa, apareciendo en la placa negativa pequeños glóbulos brillantes que explotaban, recubriéndose de una capa blanca. Estaba asistiendo al descubrimiento y obtención del:
a) Hidróxido de potasio
b) Potasio
c) Carbonato de potasio
d) Óxido de potasio
142. Para tipo de electrólisis (descomposición por acción de la electricidad), llamada ígnea, era necesario que la sustancia:
a) Fuera conductora
de la electricidad
b) Tuviera un punto
de fusión bajo
c) Fuera soluble en
el agua
d)Fuera blanda
143. Para que se produjera la electrólisis ígnea de una sal binaria, la pila empleada debería tener una diferencia de potencial:
a) Inferior a la diferencia
de los potenciales redox de los elementos constituyentes
b) Superior a la diferencia
de potencial redox de los elementos constituyentes
c) Igual a la diferencia
de potencial redox de los elementos constituyentes
d)De 220V
144*. En 1818, Mary Shelley, a los 21 años, publica “Frankenstein o el moderno Prometeo”, naciendo el famoso mito. Lo que no se publica es que el matrimonio Selley era muy amigo de Davy, el cual había asistido en 1803, al intento de revivir un cadáver, por un sobrino de Galvani, insertándole los polos de una potente batería. Davy aplicó las primeras baterías, no a resucitar cadáveres, sino demostrar que muchas de las sustancias que se creían simples, y como tales aparecían en la Química de Lavoisier (el mejor tratado de química del siglo XVIII), podían separarse por acción de la electricidad, obteniendo así sus bases, o elementos constituyentes. Descubrió de esa manera:
a) El potasio
b)El sodio
c)El calcio
d)El aluminio

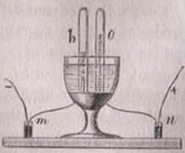
145*.La primera descomposición del agua, por efecto de la corriente eléctrica fue realizada por los ingleses Carlisle y Nicholson, en 1800, con el instrumental de la figura, observando que para que se llevara a cabo debería contener en disolución un ácido o una sal, esto era debido a que el agua:
a) Conducía la corriente eléctrica
si se calentaba con el ácido
b) No conducía la corriente por si misma
c)No se ionizaba
d)No era atraída por los polos de la pila
146*. En enero de 1834, Michael Faraday, ayudante de Davy, enuncia lo que llamó “ley de acción electroquímica definida”, a través de la cual, determina que los efectos químicos de la electrólisis (descomposición de la materia por acción de la electricidad), dependen de la cantidad de electricidad a la que estuvo sometida. De esa forma cuando sobre agua acidulada pasaba una cantidad de electricidad determinada que después se denominaría culombio siempre se desprendían:
a) 8 g de oxígeno en el polo positivo
b) 1g de hidrógeno en el polo negativo
c) 0,0000106g de hidrógeno en el polo negativo
d) 0,000082g de oxígeno en el polo positivo
147. Cuando Faraday realizó la electrólisis del agua acidulada con ácido sulfúrico, observó que los resultados eran independientes, de la concentración del ácido sulfúrico empleado, del tamaño de los electrodos (nombre empleado por él, para los polos, que después completaría con los términos cátodo y ánodo), y sólo dependía de la cantidad de electricidad. La segunda electrólisis que realizó fue la del protocloruro de estaño (cloruro de estaño(II)) , observando que en el cátodo se depositaban, cuando circulaban una cantidad determinada de carga eléctrica (96485 unidades de carga eléctrica), 58,5g. A éste peso lo denominó:
a) Peso atómico del estaño
b) Peso equivalente del estaño
c) Peso molecular del estaño
d) Peso del estaño
mientras que dicha cantidad de carga eléctrica más tarde recibiría el nombre de:
a) Culombio
b)Faradio
c)Faraday
d)Franklin
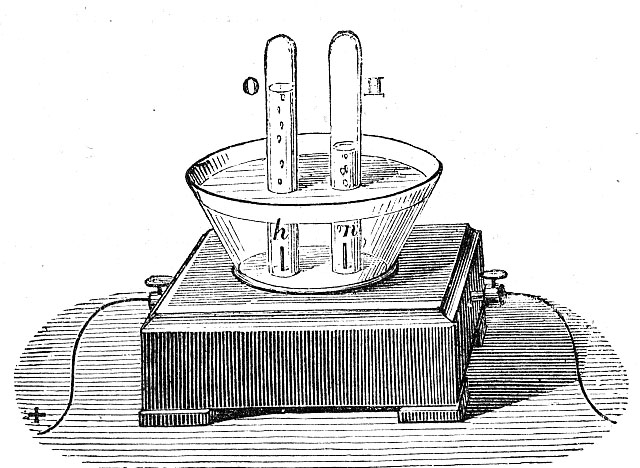
148. Para efectuar la electrólisis del agua Faraday inventó lo que llamó “volta-electrómetro”, que en 1838, Daniell cambió por voltámetro, y después, en 1902, coulómetro. En ella y en este caso, en el cátodo siempre se desprendía:
a) Oxígeno molecular
b) Oxígeno atómico
c) Hidrógeno molecular
d) Hidrógeno atómico
149. El coulombio se creó como unidad de cantidad de electricidad, en 1881, en París, en una reunión internacional de electricistas, pero fue definido en la conferencia internacional de física, 3 años después como la cantidad de electricidad que al pasar por un voltámetro de agua desprendía 0,00001016g de hidrógeno y a esta cantidad se le llamó:
a) Equivalente químico del hidrógeno
b)Equivalente electroquímico del hidrógeno
c)Peso equivalente del hidrógeno
d)Peso de un átomo de hidrógeno
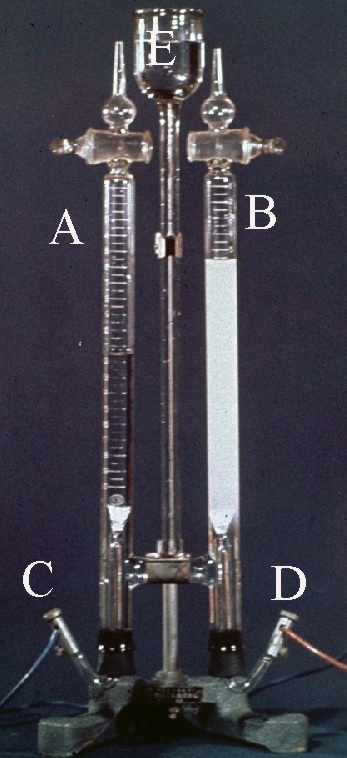
150.En 1865, se publica Hofmann su libro “Una introducción a la Moderna Química experimental y teórica”. En él aparece el voltámetro con receptáculo para las disoluciones a ser electrolizadas, de ahí que los actuales lleven su nombre. El voltámetro de la figura, se electroliza agua acidulada:
a) C es el electrodo positivo o ánodo
b) D es el electrodo negativo o cátodo
c)En A se recoge hidrógeno molecular
d)En B se recoge hidrógeno molecular
| V |
|
| F2 +2e→2F- |
2,87
|
| PbO2+2e→Pb2+ |
1,68
|
| MnO4-+5e→Mn2+ |
1,52
|
| Cl2+2e→2Cl-
|
1,36
|
| Cr2O7
2+6e→2Cr3+ |
1,33
|
| O2+4e→2H2O
|
1,23
|
| Br2+2e→2Br-
|
1,06
|
| NO3-+3e→NO
|
0,96
|
| Ag+
+e →Ag |
0,80
|
| I2+2e →2I-
|
0,53
|
| Cu2++2e →Cu |
0,34
|
| 2H+ +2e →H2 |
0,00
|
| Pb2++2e
→Pb |
-0,13
|
| Sn2++2e
→Sn |
-0,14
|
| Ni2++2e
→Ni |
-0,24
|
| PbSO4+2e→Pb Fe2++2e
→Fe |
-0,36
-0,44 |
| Zn2++2e
→Zn |
-0,76
|
| Mn2++2e
→Mn |
-1,19
|
| Al3++3e
→Al |
-1,66
|
| Mg2++2e→Mg
|
-2,37
|
| Na++e→Na
|
-2,71
|
| K++e→K
|
-2,92
|
| Li++e→Li
|
-3,05
|
151*. La electrólisis aunque es un proceso redox, los agentes oxidante y reductor no son sustancias químicas sino los electrodos de la pila donde se produce la descarga de los iones, en este caso la reacción nunca es espontánea, sino que se produce aquella que necesita menos energía libre, dada por la diferencia de potenciales redox:
a)En el ánodo una oxidación
b)En el cátodo una reducción
c)En el ánodo una reducción
d)En el cátodo una oxidación
a) Se descargará el estaño
b) Se desprenderá hidrógeno
c)Se desprenderá oxígeno
d)Se desprenderá cloro
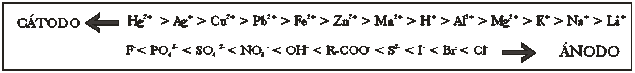
153*. Dada la tabla de iones que irán a descargarse a los electrodos respectivos en orden de prioridad
dirás que en el caso de que tuvieras disoluciones acuosas de nitrato de plata y cloruro de cobre(II), observarías que:
a)En el cátodo se descargaría primero el ion con más carga positiva
b)En el ánodo se desprendería cloro prioritariamente
c)En el cátodo se descargaría el ion plata prioritariamente
d)En el ánodo se desprendería oxígeno
154*. Hemos visto que a través de la electrólisis ígnea se pudieron obtener electrolíticamente muchos metales, con el inconveniente de fundir sus sales, sin embargo dichas sales casi siempre solubles, por lo que sería mucho más fácil disolverlos en agua y someter las disoluciones a electrólisis, para que los metales se depositaran en el cátodo. Sin embargo este procedimiento no es posible ya que :
a) Sólo valdría para obtener plata, cobre y plomo
b)Sólo se podrían obtener los metales alcalinos y alcalinotérreos
c)Se descargaría antes el ion H+
d)Sería un procedimiento muy costoso
155. Si quisiéramos hacer la electrólisis de una disolución de cloruro sódico empleando el montaje, con una pila de 1,5V , con los datos de la tabla de potenciales, veríamos que:
a) La electrólisis se pararía enseguida
b )Necesitaría una pila que generara una diferencia de potencial mayor
c)Se produciría gas cloro en el ánodo
d)Se depositaría sodio en el cátodo

Foto 1
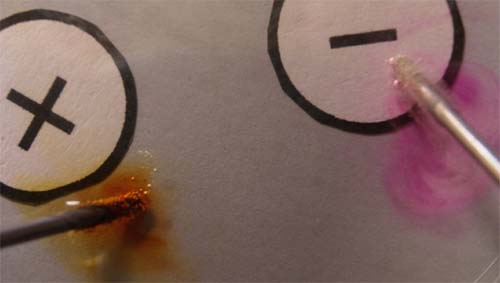
Foto 2
156. Empleando el dispositivo descrito en la foto 1, se realiza la electrólisis de una disolución de yoduro potásico al que se le ha añadido unas gotas de fenolftaleína (vira a rosa en medio básico), teniendo en cuenta la tabla de descargas del test 153, y observando la foto 2, podrás asegurar que:
a) En el cátodo se obtiene potasio
b)En el ánodo se desprende oxígeno y yodo marrón
c)La disolución obtenida tiene pH mayor de
8
d)En el cátodo se desprenden burbujas de hidrógeno
A

B
157*. Las fotos A y B, corresponde a los electrodos empleados en la electrólisis de una disolución de yoduro potásico. En la foto A, se describe los siguientes posibles procesos:
a)
![]() b)
b)
![]() c)
c)
![]() d)
d)
![]()
correspondiendo a
a) Ánodo b) Cátodo
c) Polo positivo d) Polo negativo
mientras que en la B, se producirán:
a)
![]() b)
b)
![]() c)
c)
![]() d)
d)
![]()
correspondiendo a
a) Ánodo b) Cátodo
c) Polo positivo d) Polo negativo

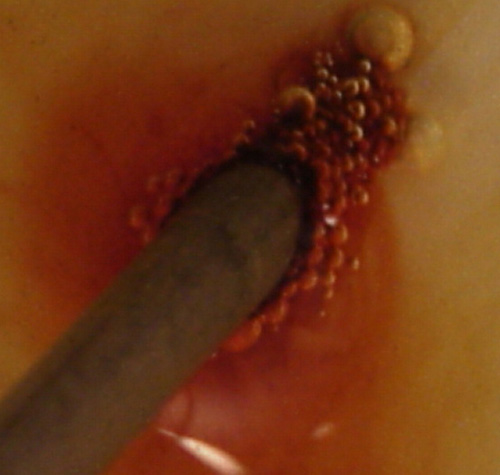
158. Se prepara la electrólisis de una disolución de cloruro de cobre (II), al que se le ha echado una gota de violeta de metilo, con un montaje similar al dado en la foto 1(test 155). En un momento determinado se realiza una foto los electrodos en dicha electrólisis, de su observación deducirás que:
a) En el cátodo se deposita cobre
b)En el cátodo se desprende hidrógeno
c)En el ánodo se desprende oxígeno
d)En el ánodo se desprende cloro
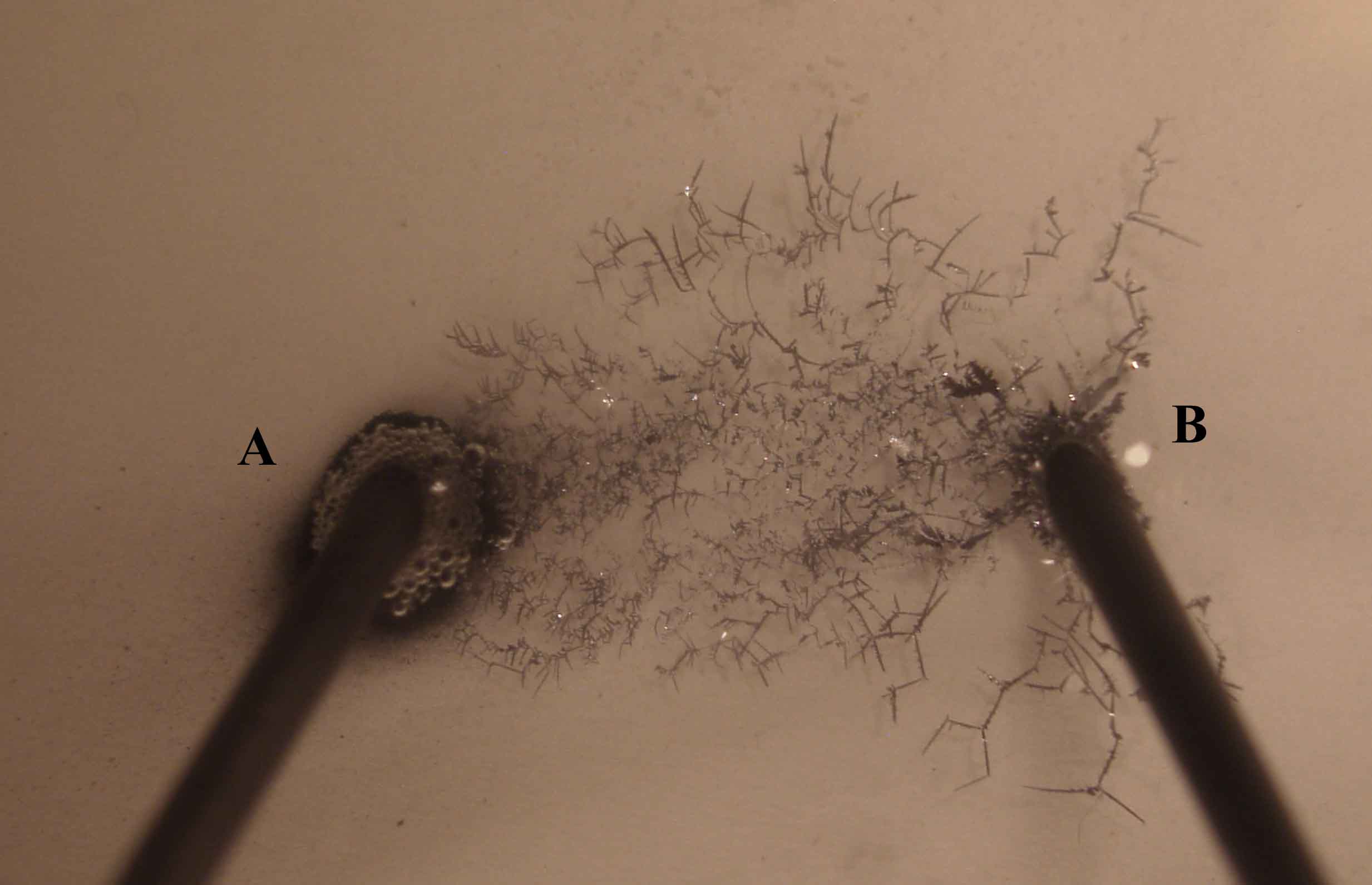
159. Se prepara la electrólisis de una disolución de nitrato de plata, con un montaje similar al dado en la foto 1( test 156). En un momento determinado se realiza una foto de dicha electrólisis, de ella deducirás que:
a)B es el cátodo
b) A es el cátodo
c)En B se produce un árbol de plata
d)En A se desprende oxígeno
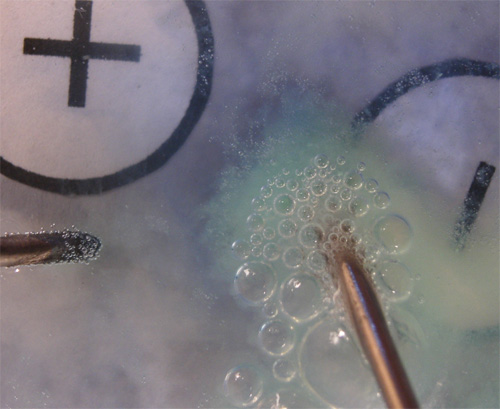
160. Se prepara la electrólisis de una disolución de bromuro sódico, al que se le ha echado una gota de azul de bromotimol (vira a azul en medio básico), con un montaje similar al dado en la foto 1(test 155). En un momento determinado se realiza una foto de dicha electrólisis, de su observación deducirás que:
a) En el cátodo se deposita sodio
b)En el cátodo se desprende hidrógeno
c)La disolución pasa de pH7 a básico
d)En el ánodo se desprende bromo