ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Redox 4
61. Cuando se realizaron los primeros ajustes de una reacción redox, todavía no se había descubierto el electrón, y por lo tanto los conceptos de oxidación y reducción no iban ligados a ellos, sino a la ganancia o pérdida de oxígeno, por eso, Bottomley en 1878, en su trabajo: “Note on a method for determining the coeficients in chemical equations”, acudió a los balances de masa, aplicando la ley de Lavoisier, y creando lo que sería llamado método de ajuste algebraico. Para ello es necesario conocer los reaccionantes y los productos de la reacción. Así si te dicen que en la descomposición de nitrato amónico se produce óxido nitroso o de nitrógeno(I) y agua, dirás que los coeficientes de las tres sustancias una vez ajustada la reacción serán por el orden dado:
a) 1,2,2 b)
1, 1,1 c) 1, 1,
2 d) 3, 2, 1
62. La pirita de hierro, es un compuesto de fórmula anómala FeS2, que al tostarla con oxígeno, va a producir dióxido de azufre y óxido de hierro(II), para ello necesitaba fuego, de ahí su nombre(de pyr, fuego en griego). El ajuste tradicional de esta reacción es bastante complejo, pero en cambio es muy sencillo a través del método algebraico. En todo caso empleando este procedimiento encontrarás que la relación entre los moles de oxígeno y los de pirita es:
a) 2 b) 2,5 c) 3 d) 1,5
63. El método algebraico, puede parecer complicado cuando en una reacción surgen muchos átomos diferentes, puesto que necesitarás más ecuaciones para poder resolverlo. Un procedimiento para obtener fósforo a partir de los huesos, es calentarlos con arena y carbón, mediante la reacción:
aCa3(PO4)2 (de los huesos)+ bSiO2 (arena)+cC
(carbón)= dP(fósforo)+eCO(monóxido de carbono) +fCa3Si2O7
El ajuste de la misma por el
método algebraico es mucho más fácil que los sistema electrónicos de ajuste,
según aquellos los coeficientes, a,b,c,d,e y f, serán:
a) 1, 2, 3, 2, 3, 1 b) 1, 2, 4, 1, 4, 1 c) 1, 2, 5, 2, 5, 1 d) 1, 2, 5, 1, 5, 1
64. En 1880, Otis Coe Johnson, en su trabajo:”Negative bonds and rules for balancing equations”, emplea un sistema de ajuste redox a través de equivalentes, definiendo los estados de oxidación, y clasificándolos en unidades positivas o negativas, surgiendo el llamado ajuste mediante el cambio en el estado de oxidación. Así en la reacción entre el amoniaco y el oxígeno gas para producir óxido nítrico ( óxido de nitrógeno(II)), y agua, el amoniaco cambiaba su estado de oxidación en 5 unidades, necesitando por ello, para ajustar la reacción:
a) 5 moles de oxígeno y formándose
6 moles de agua
b) 4 moles de oxígeno y formándose
5 moles de agua
c) 3 moles de oxígeno y formándose 4 moles de agua
d) 3 moles de oxígeno y formándose 3 moles de agua
65. El procedimiento de Johnson, será desarrollado por Hall en 1929, y Bennet, en 1935 y Morris en el 38, y naturalmente puede complicarse mucho si los componentes del proceso son muchos. Así en la reacción entre el dicromato potásico y el sulfato ferroso en medio sulfúrico, para producir sulfatos de cromo (III), de hierro(III) y de potasio, empleando el procedimiento del cambio de valencia para ajustarlo, dirás que:
a) El cromo deberá ganar 3 cargas positivas para pasar de dicromato a
cromo(III)
b) El hierro(II) deberá ganar una carga negativa para transformarse en
hierro(III)
c) Habrá que multiplicar el sulfato
ferroso por 3, para justificar las cargas
d) También se formarán 7 moléculas de agua

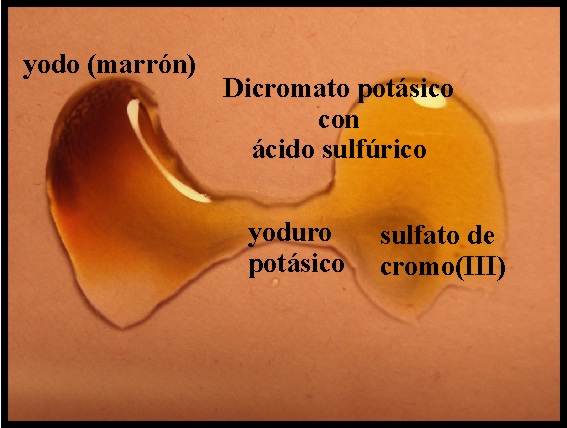
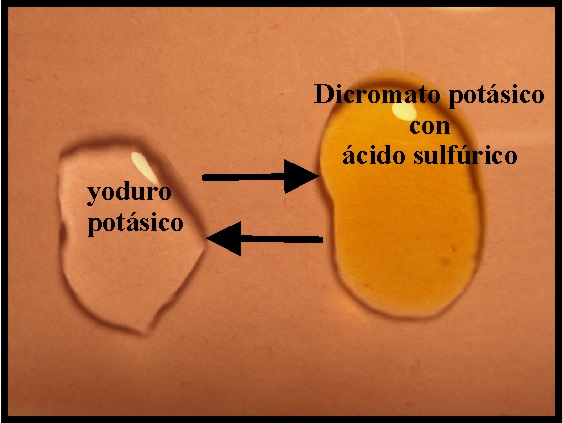
66. En las dos fotos de la figura se observa la reacción del dicromato potásico en medio sulfúrico con yoduro potásico. Si te dicen que se va a formar yodo y sulfato de cromo(III) y agua, el ajuste por el cambio de valencia te permitirá asegurar que:
a) Se forman 2 moles de sulfato crómico
b) El dicromato necesita de 6 cargas negativas para transformarse en sulfato
de cromo (III)
c) El yodo ganará 2 cargas positivas
d) Los moles de agua formada por mol de dicromato que reaccionan son 2
67*. Una vez descubierto el electrón, por J.J.Thomson, el trabajo del mismo publicado en 1904, en el Philosofical Magazine, implicando a los electrones en las reacciones electroquímicas, dio la pauta de salida a la interpretación de las reacciones redox como una transferencia de electrones, y permitió un nuevo procedimiento para el ajuste de dichas reacciones; el llamado método ion-electrón, creado por Steiglitz en 1911 y desarrollado por Eric Jette en 1927. En este procedimiento, la reacción se descomponía en dos procesos; el de reducción y el de oxidación, identificando a través del cambio del estado de oxidación el oxidante (su estado disminuye), y el reductor (su estado aumenta), de forma que el número de electrones que el oxidante toma sea igual al que el reductor pierda, multiplicando por los coeficientes necesarios, y completando los H+, o los OH-, a través del medio ácido o básico y el agua. Así en la reacción entre el permanganato potásico y el peróxido de hidrógeno en medio ácido para producir sulfato potásico, sulfato de manganeso(III), oxígeno y agua, dirás que:
a) Se descomponían así para reproducir los procesos de las pilas electroquímicas
b) En el ajuste se forman 4 moles
de agua por mol de permanganato
c) Tiene el problema de no ajustar las cargas
d) Tiene el problema de no ajustar las masas
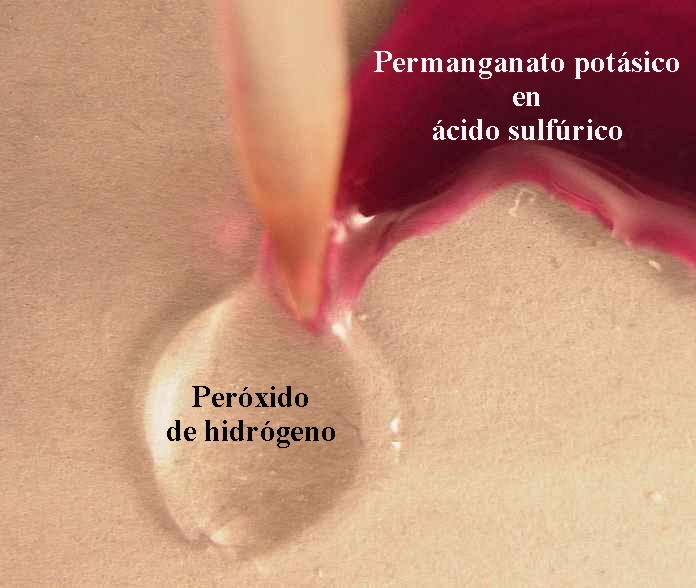
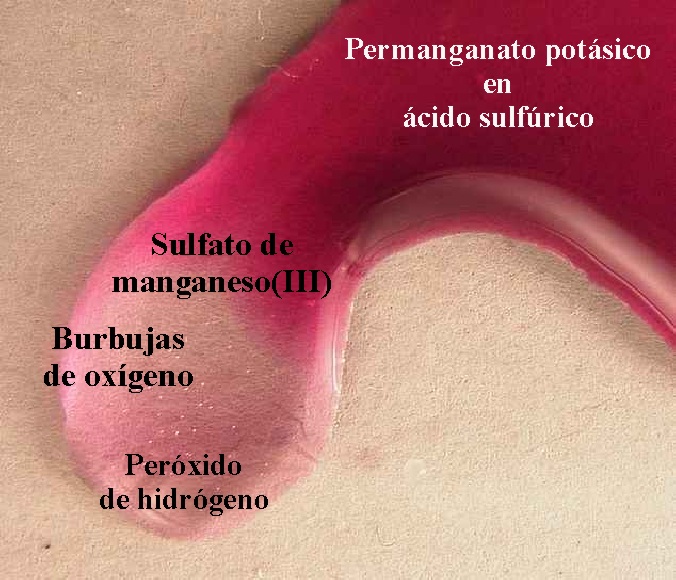
68*. En las dos fotos de la figura se observa la reacción del permanganato potásico en medio sulfúrico con peróxido de hidrógeno. Si te dicen que se va a formar oxígeno (gas) (véanse las burbujitas) y sulfato de manganeso (III) de color rosa y agua, el ajuste por el método ion-electrón te permitirá asegurar que:
a) Se forman 2 moles de sulfato
de manganeso (III) por mol de permanganato
b) Se producen 44,8 litros de oxígeno
en condiciones normales por cada mol de permanganato empleado
c) Se transfieren 8 electrones
por mol de peróxido de hidrógeno empleado
d) El reductor es el agua oxigenada
69*.Dado que en las pilas voltaicas, los procesos redox ocurren por separado en cada hemicelda de forma que el número de electrones que se pierden en la oxidación sea igual a los que se ganan en la reducción, no es de extrañar que los procedimientos de ajuste electrónico en estas reacciones tiendan a imitarlos, dividiendo el proceso en dos semirreacciones; la reducción y la oxidación, ajustándolas individualmente. Si empleas este procedimiento para la reacción entre el ácido sulfúrico y el cobre para dar sulfato de cobre(II), dióxido de azufre y agua. Dirás que:
a) El ácido sulfúrico es la especie
oxidante pues su azufre disminuye su número de oxidación
b) El reductor es el cobre, apareciendo en la oxidación
c) El ajuste implica que dos moles de sulfúrico reaccionen con un mol
de átomos de cobre
d) En condiciones normales se producirán 22,4 litros de dióxido de azufre
por cada mol de ácido sulfúrico

Foto 1

Foto 2
70. En las fotos de la figura se observa la reacción del ácido sulfúrico con el cobre (foto superior), para producir sulfato de cobre(II) azul verdoso, y dióxido de azufre que burbujea. El ajuste del proceso te permitirá asegurar que:
a)En la semirreacción de oxidación se ganan dos electrones
b)En la semirreacción de reducción interviene el cobre
c)El SO2, es la especie reducida
d)El Cu2+ es la especie oxidada
71*.Un ceramista alemán casi desconocido, Pott, descubrió a principios del XVIII, el oxidante actualmente mas utilizado en el laboratorio que llamó Scheele camaleón mineral, debido a sus sorprendentes cambios de color, y que conoces como permanganato potásico. Aunque el comportamiento de esta sustancia fue estudiado por Scheele en 1774, sólo sería explicado 50 años más tarde por Mitscherlich, en función de sus transformaciones de reducción, desde permanganato (violeta), pasando por manganato (verde) y dióxido de manganeso (precipitado marrón), hasta sal manganosa (incolora). Así, si empleas permanganato para obtener cloro a partir de un cloruro, en el proceso:
a) El MnO4- necesita de 5e- para oxidarse
b) Dos moles de permanganato reaccionan con 10Cl-
c) El ajuste se hace con 8 moles de agua
d) En condiciones normales un mol de MnO4- produciría
112 litros de gas
72. El ajuste en medio básico por el método ion-electrón (debe indicarse, con una base o el aporte de OH), sigue los mismos pasos que el que se hace en medio ácido, con la diferencia de que se contabiliza la diferencia de oxígenos entre los miembros de cada semirreacción con el doble de OH- que oxígenos fueran necesarios. Los H+ residuales se situarían en el otro miembro en forma de moléculas de agua. Por eso si el óxido de cromo (III) se oxida a cromato por la acción de un nitrato en medio básico, que a su vez se transforma en nitrito, y ajustas la reacción, dirás que:
a) Se necesitarán 3 OH- por cada mol de óxido de cromo(III)
b) La especie oxidante es el ion nitrato
c) Se eliminarán 2 moles de agua
d)El número de electrones que se pierden en la oxidación es 5

Foto 1

Foto 2
73. En las fotos de la figura se observa la reacción del permanganato potásico en medio básico (KOH) con sulfito sódico. Si te dicen que se va a formar manganato potásico (verde), sulfato sódico y agua, y ajustas la reacción por el sistema ion-electrón podrás asegurar que:
a) En la oxidación, el Mn del permanganato pierde
un e-
b) El sulfito sódico es la especie reductora
c) El potencial normal de oxidación
del permanganato deberá estar por encima del potencial normal del sulfato
d) El ajuste global implica 2 moles
de permanganato y 2 de hidróxido potásico por cada mol de sulfito
74*.En 1774, Carlos Guillermo Scheele, uno de los mejores químicos farmacéuticos de todos los tiempos, trabajando con magnesia nigra (después sería dióxido de manganeso) que hace reaccionar con ácido marino o ácido muriático (ahora lo conoces como ácido clorhídrico), obtiene un producto que al ser removido desprende un gas "que poseía un olor especial y que cuando se respiraba oprimía los pulmones" y la sal muriática del manganeso (después cloruro de manganeso(II) Este es el relato del descubrimiento del cloro. En este proceso dirás que:
a) El manganeso 4+ tuvo que ganar electrones
b) El cloro tuvo que oxidarse,
al subir en su número de oxidación, perdiendo electrones
c) El dióxido de manganeso actuó como sustancia
oxidante
d) La reacción no pudo realizarse
en condiciones normales pues el cloro es más oxidante que el dióxido de manganeso
| V |
|
| F2 +2e→2F- |
2,87
|
| PbO2+2e→Pb2+ |
1,68
|
| MnO4-+5e→Mn2+ |
1,52
|
| Cl2+2e→2Cl-
|
1,36
|
| Cr2O7
2+6e→2Cr3+ |
1,33
|
| O2+4e→2H2O
|
1,23
|
| Br2+2e→2Br-
|
1,06
|
| NO3-+3e→NO
|
0,96
|
| Ag+
+e →Ag |
0,80
|
| I2+2e →2I-
|
0,53
|
| Cu2++2e →Cu |
0,34
|
| 2H+ +2e →H2 |
0,00
|
| Pb2++2e
→Pb |
-0,13
|
| Sn2++2e
→Sn |
-0,14
|
| Ni2++2e
→Ni |
-0,24
|
| PbSO4+2e→Pb Fe2++2e
→Fe |
-0,36
-0,44 |
| Zn2++2e
→Zn |
-0,76
|
| Mn2++2e
→Mn |
-1,19
|
| Al3++3e
→Al |
-1,66
|
| Mg2++2e→Mg
|
-2,37
|
| Na++e→Na
|
-2,71
|
| K++e→K
|
-2,92
|
| Li++e→Li
|
-3,05
|
75.La materia prima más abundante del cloro, sería la sal común, NaCl, sin embargo si quisiéramos obtenerlo de esta sal, no deberíamos emplear un ácido fuerte para desplazarlo, sino un oxidante enérgico para oxidar al cloro. Para ello, si tenemos en cuenta la tabla de potenciales normales de reducción dada, se podría conseguir con:
a) Dicromato potásico
b) Bromo
c) Permanganato potásico /
d) Fluoruro sódico
76*.El acero galvanizado se denomina así porque en una celda galvánica se recubre de una homogénea y fina película de cinc. De esta forma se protege contra la corrosión por que:
a) El cinc tiene un potencial de
reducción menor
b) El hierro actúa como cátodo y el cinc como ánodo
c) El cinc suministra electrones
al oxígeno
d) El cinc proporciona electrones
al óxido férrico
e) El cinc forma un hidróxido impermeable
al oxígeno
77*. Plinio en el siglo I DC, llamó al mercurio obtenido a partir del cinabrio, minio, por su color (minius es rojo, en latín), tal como el río Miño, cuyas aguas arrastraban tierras rojizas arcillosas. Sin embargo, actualmente, el minio se aplica al óxido doble de plomo II y IV, también de color rojizo, que se emplea para evitar la corrosión del hierro. El uso de metales más reductores que suministren electrones al oxígeno o de metales que formen óxidos o hidróxidos impermeables al atacante, y que por ello se vuelvan pasivos ante el oxígeno (de ahí el nombre de pasivado), son las técnicas mas empleadas contra la corrosión . Esto motivó que:
a) Las primeras baterías de cocina fueran de aluminio
b) La hojalata (hierro+estaño)
se emplee desde el siglo XVII como envase de conservas
c) Los cables de acero se recubran de cinc
d) Los metales, especialmente el hierro, se niquelen
a) El metal actúa como ánodo
b) El oxígeno será el cátodo
c) Si se le suministran electrones al oxígeno se protegerá al metal
d) Cuanto mayor sea la humedad ambiental menor será la corrosión
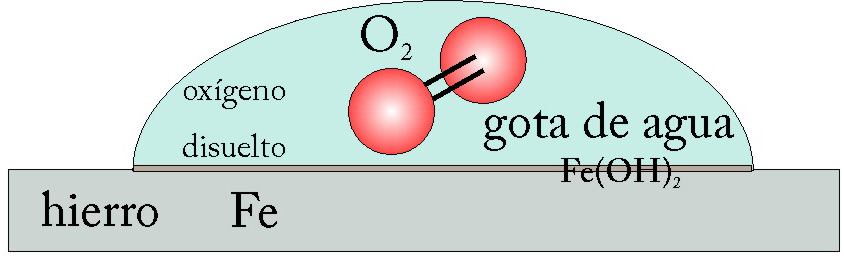
79. En el esquema dado, se representa la acción de una gota de agua sobre una plancha de hierro, que le va a producir corrosión, con la formación de hidróxido de hierro(II). Según lo dado y si ajustas el proceso por el procedimiento ion- electrón podrás asegurar que:
a) El agua será la sustancia oxidante
b)El oxígeno del aire tomará 2 electrones al hierro
c)La reacción se realiza sólo en medio ácido
d)El hierro es el agente reductor que actúa en la semirreacción de oxidación
80*. Aunque aparentemente parece que no tiene importancia, cuando salta una piedra que choca contra la carrocería de un automóvil, realmente sí la tiene, pues al cabo de cierto tiempo podrás observar que precisamente en la huella dejada es donde ha surgido una mancha de óxido. Lo mismo suele ocurrir en las uniones, zonas con tornillos etc. Sin embargo no es en la grieta formada en la pintura donde se produce el ataque del oxígeno, sino que tal como observas en el dibujo anterior. De la reacción producida dirás que
a) Un mol de oxígeno se come a
dos moles de átomos de hierro
b) La reacción transfiere 4 electrones
c) Se formaran en ella dos moles de hidróxido ferroso
d) Dado que el hidróxido ferroso es reductor ( E0=0,56V), y
permeable al oxígeno, seguirá oxidándose por lo que la corrosión no parará