ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
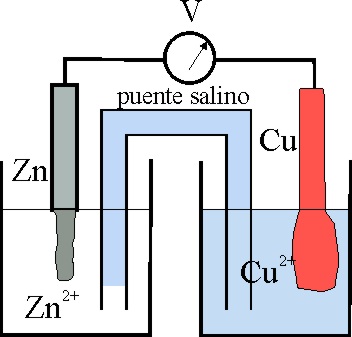
21*. El número de oxidación, índice de oxidación o estado de oxidación fue definido por primera vez en 1880, por el inglés Otis Coe Johnson, como el número de cargas que un elemento aporta a la formación eléctrica de un compuesto, por eso podrás comprender fácilmente que el oxidante disminuirá su número de oxidación y el reductor lo aumentará. Así, dado el esquema de la pila Daniell, podrás asegurar que:
a) El Cu2+ actúa como oxidante
b) El cinc al disolverse reduce al cobre
c) En la hemicelda del Zn ocurre una oxidación
d) En la hemicelda del Cu ocurre una reducción

22*.Faraday, descubridor del butileno (después buteno), y del benzol (posteriormente benceno), fue inicialmente y debido a sus medios económicos un autodidacta, aunque después fuera discípulo de Davy, por eso tuvo que recurrir a la ayuda de un amigo filósofo e historiador, William Whewell, para crear los nombres, tan usados en electroquímica, derivados del griego, como ión (caminante), ánodo (camino hacia arriba), cátodo (camino hacia abajo), basándose en la migración de las cargas, electrodo (camino de la electricidad), electrolito y electrolisis (disolución por la electricidad). Sin embargo el sentido real del ánodo y del cátodo implica que:
a) El ánodo es la hemicelda donde
se produce la oxidación
b) El cátodo es la hemicelda donde se produce la
reducción
c) El ánodo es el electrodo negativo
d) El cátodo es el
electrodo positivo
e) El ánodo es el electrodo
que toma electrones
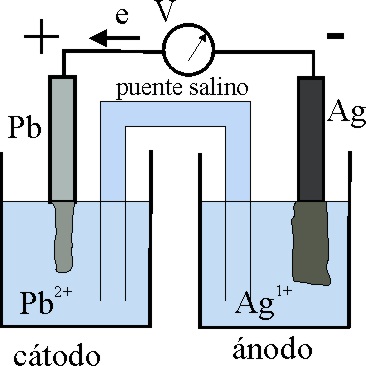
23*.Basándose en lo dicho anteriormente, y sabiendo que una lámina de plomo se disuelve en nitrato de plata, en el esquema de la pila dada, los errores que en él se aprecian serán:
a) La denominación de ánodo
b) La caracterización del cátodo
c) El sentido del movimiento electrónico
d) Los polos de la pila
24. La IUPAC, distingue entre el número de carga de un elemento químico y el estado de oxidación, aunque conceptualmente sean similares, el primero lleva el signo de la carga, positiva o negativa, delante, mientras que el segundo lo lleva detrás, así el nitrógeno en el amoniaco tiene un estado de oxidación de:
a) 3 b) -3 c) 3- d) 3+
mientras que el número de carga del nitrógeno en el compuesto será:
a) 3 b) -3 c) 3- d) 3+
25. El mejor diagnóstico para identificar si una reacción es redox, es apreciar si existe variación en los números de oxidación de los protagonistas de dicha reacción, concepto que ya parece surgir a partir del trabajo de Abegg, en 1904, sobre valencias positivas y negativas, complementándose con los de Kossel en 1916, y culminando con los de Latimer en el 38. Actualmente se entiende como el número de cargas positivas o negativas que un elemento aporta a la formación de la especie química neutra o con carga en la que está integrado. Por eso, teniendo en cuenta que el O combinado, salvo en los peróxidos actúa dando dos cargas negativas y que el H combinado actúa con una positiva, podrás decir que los números de oxidación de los elementos X,Y y Z, integrados en las sustancias: HXO4,H2Y2O72-, y NaHZO4-, son respectivamente :
a) 4+,+5,+5 b) 7+,6+,5+
c) +7,+5,+5 d) 8+,5+,6+
26. Por lo general suele adscribirse al H el número de carga de 1+ y el oxígeno de 2-, no siempre ocurre así ya que depende de la electronegatividad de los otros elementos con los que se encuentra combinado así el primero cuando se combina con elementos del grupo 1, actúa siempre como:
a) -1 b) 1+ c) +1 d) 1-
mientras que el oxígeno cuando se junta al hidrógeno en el peróxido de hidrógeno, actúa como:
a) 2- b) 1+ c) +1 d) -1
27.En un mismo compuesto un elemento puede existir en diferentes estados de oxidación, así el N, en el nitrito amónico (NH4)NO2 los dos N, por el orden escrito tienen números de oxidación o estados de oxidación:
a) -3 y +3 b) +3 y -3 c) 3+ y 3- d) 3+ y 5-
28. En los compuestos orgánicos el C puede presentar múltiples estados de oxidación, así en la serie: metano, metanol, metanal y metanoico, el número de carga del carbono será sucesivamente:
a) -4, -2, 0, +2 b) 4+, 2+, 0, 2- c) 3-, 0, 2+,2- d) 3+,2+, 0,2-
| V |
|
| F2 +2e→2F- |
2,87
|
| PbO2+2e→Pb2+ |
1,68
|
| MnO4-+5e→Mn2+ |
1,52
|
| Cl2+2e→2Cl-
|
1,36
|
| Cr2O7
2+6e→2Cr3+ |
1,33
|
| O2+4e→2H2O
|
1,23
|
| Br2+2e→2Br-
|
1,06
|
| NO3-+3e→NO
|
0,96
|
| Ag+
+e →Ag |
0,80
|
| I2+2e →2I-
|
0,53
|
| Cu2++2e →Cu |
0,34
|
| 2H+ +2e →H2 |
0,00
|
| Pb2++2e
→Pb |
-0,13
|
| Sn2++2e
→Sn |
-0,14
|
| Ni2++2e
→Ni |
-0,24
|
| PbSO4+2e→Pb Fe2++2e
→Fe |
-0,36
-0,44 |
| Zn2++2e
→Zn |
-0,76
|
| Mn2++2e
→Mn |
-1,19
|
| Al3++3e
→Al |
-1,66
|
| Mg2++2e→Mg
|
-2,37
|
| Na++e→Na
|
-2,71
|
| K++e→K
|
-2,92
|
| Li++e→Li
|
-3,05
|
29*. Las medidas de los potenciales normales de reducción, permiten determinar la capacidad oxidante o reductora de las diferentes especies químicas, tomando al electrodo de hidrógeno como patrón, en condiciones estándar, tal como se ha realizado anteriormente. Por eso, si tenemos en cuenta que los potenciales normales más positivos representan a las especies más oxidantes mientras que los más negativos son los más reductores, y refiriéndonos a la tabla adjunta, podremos decir que :
a) El flúor es la especie más oxidante, mientras
que el litio será la más reductora
b) Los elementos situados a la
derecha del sistema periódico (excluidos los gases nobles), son mas oxidantes,
pues son mas electronegativos
c) Los metales más reductores son
los alcalinotérreos
d) La mayor diferencia de potencial generada por una pila electroquímica, en condiciones normales, sería de 6V
30*.Una de las reacciones químicas de desplazamiento más estudiada en química elemental es aquella en la que un ácido fuerte con un metal producía una sal y desprendía hidrógeno, por ejemplo ácido sulfúrico y cinc. Sin embargo realmente esta reacción es redox, y teniendo en cuenta la tabla anterior, podremos decir de ella que:
a) El H+ del ácido sulfúrico debería
ganar electrones, y eso solo puede ocurrir si el metal es más reductor que
él
b) No debería producirse hidrógeno
si empleamos limaduras de cobre en la reacción
c) El hidrogeno no se liberaría
si el sulfúrico actúa como reductor, en lugar del H+
d) Si el sulfúrico actuara como oxidante lo que se desprendería sería ácido sulfuroso o mejor dióxido de azufre
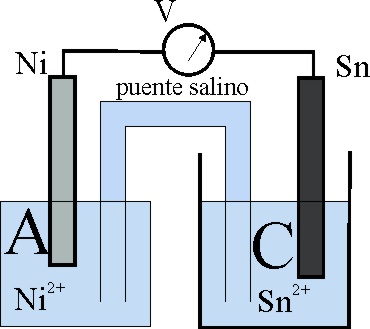
31. En el esquema de la pila dado, sabiendo que las disoluciones tienen igual concentración, y teniendo en cuenta la tabla de potenciales normales dirás que:
a) La reacción química Sn + Ni2+ -> Sn2+ + Ni
transcurrirá espontáneamente en el sentido indicado
b) Los electrones circularán del Sn al Ni
c) A será el ánodo
d) En C se produce una reducción
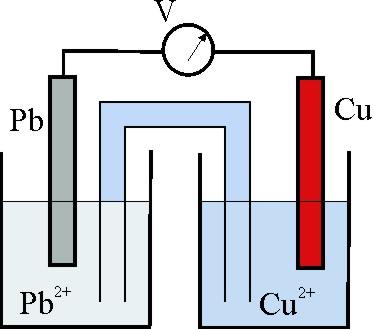
32. En la foto de la pila, disponemos de las
hemiceldas Cu2+/Cu (obsérvese la disolución de color azul del sulfato
de cobreII) y Pb2+/Pb, unidas por un puente salino, y conectadas
a un voltímetro, teniendo en cuenta los potenciales normales podrás asegurar
que:
a) La reacción química Cu2+ + Pb -> Pb2+ + Cu
transcurrirá espontáneamente en el sentido indicado
b) A, será el ánodo de la pila
c) D, será el polo positivo de la pila
d) Los electrones irán de C a D

33*.Realmente aunque se le atribuye a Volta el invento de la pila, los documentos históricos y arqueológicos no están de acuerdo con ello, pues en 1936, König, arqueólogo alemán, encontró en las excavaciones de Khujut Rabuat, cerca de Bagdad, una especie de pila datada sobre el 300aC formada por elementos de hierro y cobre. Este hecho explicaría algunos procesos químicos, conocidos desde el año 2500 aC, como el dorado de los metales, sólo posible por métodos electroquímicos. Conociendo la escala de potenciales, podrías decir de esta primera pila que:
a) Posiblemente empleará el hierro
como reductor
b) El oxidante sería un compuesto de cobre(II)
c) La diferencia de potencial conseguida, seria superior a la de la pila
Daniell, en condiciones normales
d) Los electrones circularían del hierro al cobre

34*.En esta fotografía de la pila Daniell se ha sustituido la hemicelda que contenía cinc, en una disolución de nitrato de cinc, por cobre sumergido en una disolución de sulfato de cobre 0,01M. Al ser el mismo metal podrás asegurar que:
a) No se producirá corriente
b) A, será el ánodo
c) Se generará una diferencia de
potencial pequeña
d) Se formará una pila de concentración
35. El simbolismo de la pila anterior será:
a)
![]() b)
b)
![]()
c)
![]() d)
d)
![]()
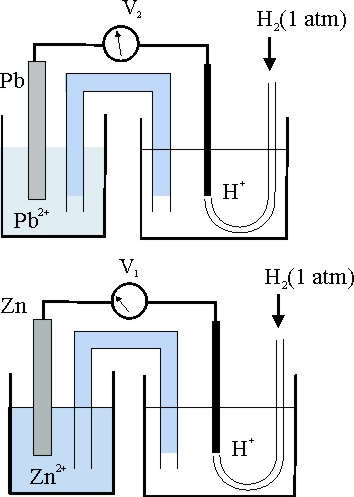
36*.En el esquema de la figura se muestran 2 pilas electroquímicas referidas al electrodo patrón conectadas a voltímetros con la aguja calibrada al medio de la escala en condiciones estándar. Si V1 marca -0,76V y V2 -0,13V, podrás decir que la pila formada por las dos hemiceldas de la izquierda conectadas entre sí :
a) El voltímetro marcaría 0,89v
b) El sentido de la corriente por
el circuito externo iría del Pb al Zn
c) La reacción redox transcurriría espontáneamente en el sentido Zn²+
+ Pb = Zn + Pb²+
d) El electrodo del plomo sería el cátodo
37*. Sabiendo que la pila Daniell genera 1,1V y considerando el test anterior, en la pila galvánica dada, podrás decir que:
a) Se produciría una diferencia de potencial de 0,46V
b) El Cu²+ actuaría como reductor
c) Los electrones irían del Pb al Cu por el circuito exterior
d) El cátodo sería la hemicelda del plomo
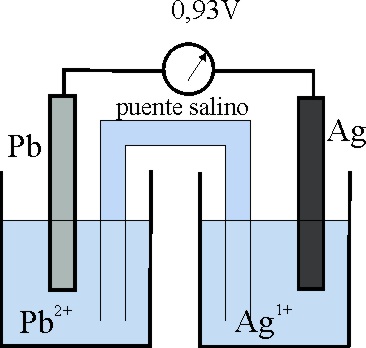
38. Con el esquema de la pila Ag/Pb que te dan, cuyo voltímetro indica 0,93V aplicando tus conocimientos anteriores, podrás asegurar que:
a) Los electrones irían del plomo a la plata
b) El Ag+ sería capaz de oxidar al hidrógeno
c) La lámina del plata tendería
a disolverse
d) El potencial normal de reducción o potencial normal redox de la plata
para la reacción Ag+ + e- = Ag, sería de 0,80V
39. En la pila de concentración de la figura, basada en los electrodos de cobre, el voltímetro marca 81,4mV, y la disolución A de sulfato de cobre(II), es 1M, por lo tanto dirás conociendo el potencial normal estándar del par Cu2+/Cu (0,34V), que la concentración de la disolución B, será aproximadamente en mol.L-1:
a) 0,001 b) 0,002
c) 0,0001 d) 0,00001


40*. Si en la pila Daniell, sustituyéramos el electrodo de cinc, por una moneda de plata, en una disolución de nitrato de plata, tal como muestra la figura, dirás que:
a) Están mal conectados los bornes al voltímetro, por lo que marcará una
diferencia de potencial negativa
b) Los electrones pasan por el circuito externo de la lámina de cobre
a la moneda de plata
c) La hemicelda donde está la lámina de cobre es el cátodo
d) La moneda de plata es el polo positivo de la pila