
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
1.Un profesor de anatomía de la Universidad de Bolonia, va a realizar entre 1780 y 1786, las experiencias que serán el punto de partida para poder crear lo que sería el primer generador de corriente continua. Todo comenzó cuando las extremidades de una rana recién muerta, empezaron a convulsionarse, al saltar chispas de un condensador próximo, y repetirse el hecho al ser tocada por dos metales diferentes, aplicados tal como se describe en la figura. Este hecho, explicado incorrectamente por el citado profesor, Luis Galvani, fue aclarado posteriormente por su compatriota Alejandro Volta, profesor de física de la Universidad de Pavía, basándose en que:
a) La rana poseía un fluido eléctrico en su estructura
b) El contacto de dos metales diferentes
producía una tensión eléctrica
c) Había dos tipos de electricidad que al estar en contacto producían
chispas
d) Se había creado una fuente de electricidad que se descargaba a través
de la rana

2*. Aunque inventó algunos de los aparatos más empleados en un laboratorio elemental de electricidad, como el electroscopio o el electróforo, los mayores beneficios económicos, honoríficos e incluso políticos, se los debió Volta al interés que se tomó Napoleón por su invento, que en principio llamó órgano eléctrico artificial, y que ahora conocemos como pila eléctrica. Del primer montaje realizado, cuya fotografía se adjunta, podrás concluir que:
a) Se basaba en la diferente naturaleza de los metales plata y cinc
b) Tenía que unir dichos metales por un aislante
c) Debía comunicar los metales
a través de un líquido que condujera la carga eléctrica
d) Lo que realmente había creado es lo que conocemos con el nombre de
una batería
3*. Debido a la participación en su creación de los profesores Galvani y Volta, el generador de corriente continua recibió los nombres de:
a) Pila voltaica b) Voltámetro
c) Pila galvánica
d) Galvanómetro
4*. Mientras que le nombre que dio Volta al primer generador de corriente continua: órgano eléctrico artificial, se basaba en su comparación con los órganos eléctricos naturales del pez torpedo o de la anguila eléctrica, el que se emplea actualmente: pila voltaica o galvánica, surge del amontonamiento o apilamiento, tal como puede observarse de los elementos formados por discos de cobre o plata y estaño o cinc. De esta primera pila podrías decir que no funcionaría si los discos fueran:
a) Todos de plata
b) De cobre y plata
c) De estaño y cinc
d) De cobre y estaño

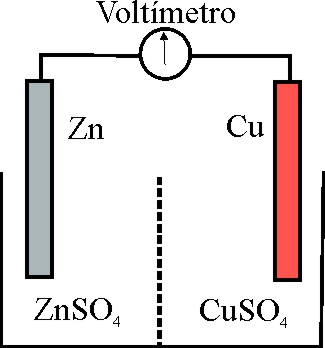
5*. Aunque la primera pila de Volta, nace con el siglo XIX, y en 1834, Grove produce energía eléctrica por unión del oxígeno con el hidrógeno, hasta 1839 no se creará la pila precursora de las de uso actual. Su montaje fue realizado por un profesor de química del Colegio del Rey, de Londres, Juan Federico Daniell. De su esquema, llegarás a concluir que :
a) Está formada por dos partes o hemiceldas
b) Cada hemicelda
contiene un metal sumergido, en una disolución de una sal
del mismo
c) Las hemiceldas estaban comunicadas por una
pared que permitía el intercambio iónico
d) Un voltímetro intercalado indicaría
una diferencia de potencial entre hemiceldas
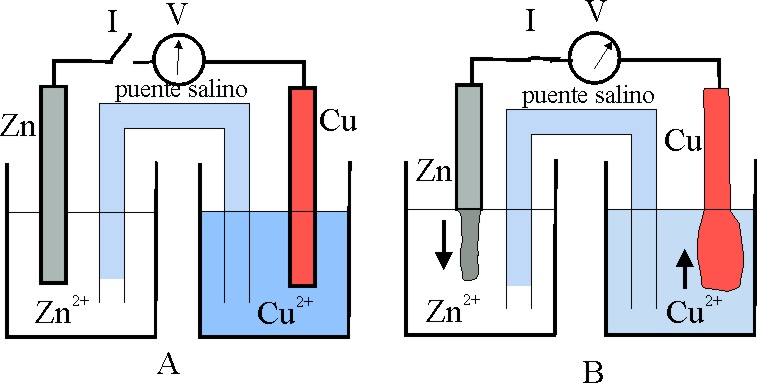
6*. Si un montaje elemental de la pila Daniell, lo observamos en A, antes de cerrar el interruptor I y al cabo de cierto tiempo, en B, una vez cerrado I, notaremos unas claras diferencias, que nos obligarán a asegurar que:
a) El cinc se ha disuelto, aumentando la concentración de Zn2+
b) El Cu2+, de la disolución, en su hemicelda
se deposita en forma de cobre metálico
c) Los átomos de cinc de la barra
han ganado 2 cargas positivas, mientras que cada Cu2+ ha tenido
que perderlas
d) Las cargas positivas que el Zn pierde, las gana el Cu 2+
e) Existirá un transporte de cargas eléctricas negativas, desde la barra
de Zn a la de Cu
7*. Si las dos hemiceldas de la pila Daniell sólo estuvieran comunicadas por el circuito externo, la carga acumulada en las láminas al producirse las reacciones redox, impediría la continuidad del proceso, y por otra parte el uso de una pared porosa como separación, facilitaría la mezcla de disoluciones con el peligro de que ocurran fenómenos secundarios que alteren el proceso. Por eso, lo idea es emplear lo que se denomina, puente salino, esto es un tubo en U invertida, que previamente se llenó de una disolución de que facilite la propagación de la carga, bloqueándose con dos algodones en sus extremos (se puede sustituir por papel de filtro humedecido). Para que funcione correctamente, ésta deberá ser de:
a) Agua destilada
b) Una disolución de sal común
c) Agua acidulada
d) Cualquier sal
8*.En la fotografía adjunta se presenta una pila Daniell, conectada a aun voltímetro que marca 0,00V. Esto es debido a que:
a) El circuito está interrumpido
b) Falta el puente salino
c) Están mal conectados los electrodos
d) El voltímetro no funciona


9*. En la foto de la figura aparece una pila Daniell funcionando, con las dos hemiceldas, conectadas a un voltímetro, y un papel de filtro doblado sumergido en ambas disoluciones. Pero para que realmente el voltímetro marque una diferencia de potencial hace falta que dicho papel se impregne del líquido contenido en A, que podrá ser:
a) Agua destilada
b) Sal común
c) Agua acidulada
d) Cualquier sal
10*. El conocimiento de los procesos que tienen lugar en las pilas voltaicas, no podrá ser completo, sin el estudio de las reacciones químicas que en ellas ocurren, denominadas de oxidación-reducción, y aunque la primera definición de la oxidación fue realizada ya en 1780, por Lavoisier, como la ganancia de oxígeno por parte de una sustancia simple o compuesta, y la reducción incluso se conocía en tiempos de Geber (800 d.C.), definiéndola así por la pérdida de peso que experimentaban los compuestos metálicos al combinarse con determinadas sustancias como el carbón, actualmente debes saber que :
a) La oxidación es la pérdida de
electrones b) Un oxidante
gana electrones
c) La reducción es la pérdida de electrones d) Un reductor se oxida
e) No hay oxidación sin reducción
11.Los términos ánodo
y cátodo
, fueron creados en
1834 por Faraday
aconsejado por el profesor del Trinity College, de Cambridge, William Whewell
..
Expone Faraday
en “Experimental Researches
in Electricity” de 1838: “De tal forma que la
electrodescomposición podía considerarse como la descomposición del cuer-po así situado de tal modo que la corriente pudiera pasar
en la misma dirección y paralelamente a la que se supone existe en la Tierra.
Sobre este movimiento de las cargas, propongo llamar ÁNODO, el camino hacia
el este, por el cual sube el sol, y CÁTODO, la vía hacia el oeste, o el camino
por el que el sol se pone”.
a)A
b) B
c) C d) D e) E

12.Las pilas electroquímicas se pueden
simbolizar a través de los procesos de oxidación reducción realizados en ellas,
primero lo que ocurre en el ánodo y después lo que sucede en el cátodo, teniendo
en cuenta que el puente salino se representa por
![]() , dirás que la pila Daniell se representa por:
, dirás que la pila Daniell se representa por:
a)
![]() b)
b)
![]()
c)
![]() d)
d)
![]()
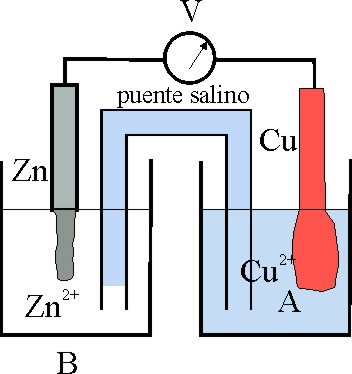
13*. En la pila Daniell, cuyo esquema te dan, una vez transcurrido cierto tiempo podrás asegurar que:
a) A es una disolución de sulfato de cobre(II),
con menor concentración de la inicial
b) B es el cátodo de la pila
c) El Cu 2+, tomó 2
electrones oxidándose a Cu
d) La reacción redox que se realizó espontáneamente sería:
CuSO4 + Zn -> ZnSO4
+ Cu
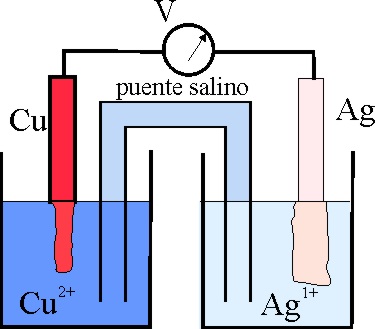
14*. La interpretación del esquema que se adjunta te permitirá afirmar que:
a) El comportamiento del Cu es muy diferente al presentado en la pila
Daniell
b) La Ag disminuyó de concentración porque se
redujo
c) El procedimiento se podría emplear
para platear una lámina metálica
d) En la disolución final también habrá Cu++
e) Por cada 2 moles de átomos de plata depositados sobre el cobre, se
habrá disuelto un mol de átomos de cobre

15*.Si en la pila Daniell, analizados los fenómenos anteriores, sustituyeras la hemicelda del Zn por otra de plata sumergida en una disolución que contiene Ag+ (algunos de los fenómenos externos producidos se manifiestan en el dibujo adjunto) su observación y análisis detallado, te obligarán a decir que:
a) El Cu que había actuado como oxidante frente al Zn, aquí frente a la Ag será reductor
b) La circulación de la corriente por el circuito externo se hará desde
la lámina de Ag a la de Cu
c) La aguja del galvanómetro se desviará en sentido contrario al efectuado
en la pila Daniell
d) En la hemicelda de la plata ocurre una oxidación
16. El esquema simbólico de la pila anterior de todos los dados :
a)
![]() b)
b)
![]()
c)
![]() d)
d)
![]()
Será el a) A b)B c) C d) D
17. Como se ha visto, los metales tienen distintas tendencias a perder electrones, e incluso pueden ganarlos Este hecho expuesto de otra forma mas elemental era conocido mucho tiempo antes, pues ya Berzelius en 1819,había clasificado los elementos desde los más positivos, comenzando en el potasio hasta los más negativos como el oxígeno. Ahora bien, para hacer una verdadera escala, hay que establecer un patrón y una forma de medida. Esto es lo que se ha hecho con la hemicelda o electrodo de hidrógeno. En él y a la reacción 2H+ + 2e- = H2(gas), en condiciones normal eso estándar, se le atribuyó un potencial normal E0 dado en voltios de
a) 1 b)-1 c) 0 d) 0,00
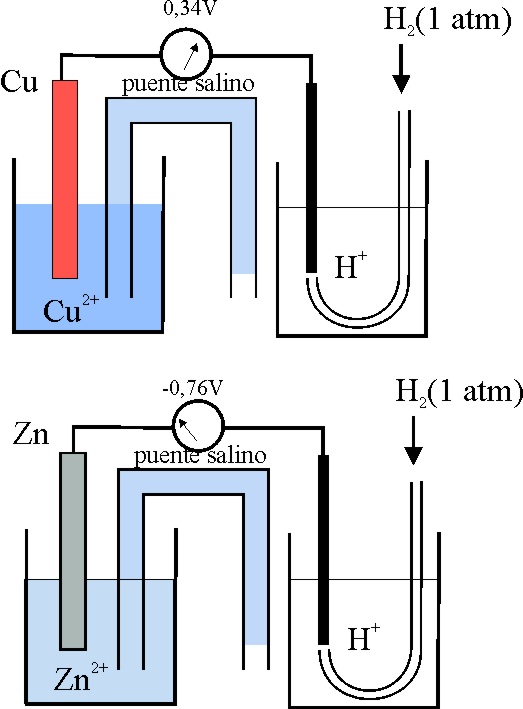
18. Si montamos 2 pilas con hemiceldas Cu++/Cu y Zn++/Zn, referidas al electrodo patrón de hidrógeno, tal como expresa el esquema adjunto y las conectamos a un voltímetro, con aguja calibrada al medio de la escala, observaremos que en el primer caso marca 0,34V, mientras que en el segundo -0,76V.Todo ello te servirá para justificar que :
a) La diferencia de potencial que proporcione la pila Daniell será de 1,1 voltios
b) El Cu2+ robe electrones al Zn2+
c) El Zn sea mas reductor
que el hidrógeno, ya que su potencial de reducción es menor
d) El Cu sea mas oxidante
que el hidrógeno ya que su potencial normal de reducción es mayor
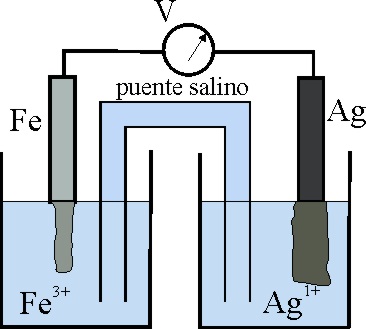
19*. La interpretación del dibujo y esquema que se adjunta te permitirá afirmar que:
a) El potencial normal de reducción del par
Ag+/Ag, es mayor que el del Fe3+/Fe
b) La Ag+ disminuyó de concentración
porque se redujo
c) La hemicelda
Fe3+/Fe es el cátodo de la pila
d) La corriente circula por el conductor metálico del Fe al Ag
20. El esquema de la pila anterior, permite un simbolismo posible:
a)
![]() b)
b)
![]()
c)
![]() d)
d)
![]()
de todos los dados el único correcto será el a) A b) B c) C d) D