
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
DICROMATO POTÁSICO Y MONEDAS III
Siguiendo la reacción de monedas españolas con oxidantes, ahora veremos
la acción del dicromato potásico
3.Dicromato potásico
diluido y moneda española de 50cts de peseta de 1966
(Composición : 90% aluminio) Comparación con el caso
2.
Trabajando como en prácticas anteriores, con una gota de K2Cr2O7 . Al agregar una gota de ácido clorhídrico diluido para activar el oxidante, el metal reacciona violentamente (fig.1-5), con desprendimiento de hidrógeno, produciéndose también sal de cromo (III) verdosa. Al cabo de varios días la moneda toma el aspecto de la fig 6.

Fig.1
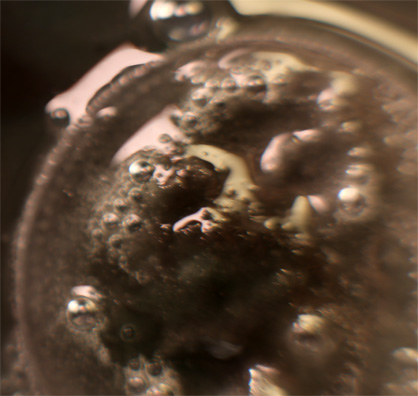
Fig.2 (detalle)

Fig.3

Fig.4

Fig.5(ampliación)

Fig.6
Fig.11
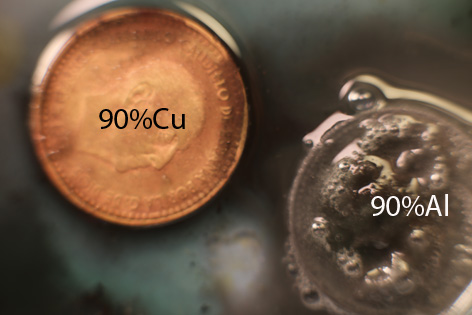
Fig.7
Fig.8
Fig.9
Fig.10
Los procesos redox fundamentales que
tienen lugar son:
REDUCC: K2Cr2O7 +14HCl+6e
= 2Cr3++2K++14H+ +7O2-+14Cl-
OXIDAC: 2Al - 6e = 2Al3+
________________________________________________
K2Cr2O7 +2Al= 2AlCl3+ 7H2O+
2CrCl3 +2KCl
REDUCC: 6HCl+6e = 6Cl-+3H2
OXIDAC: 2Al - 6e = 2Al3+
________________________________________________
6HCl +2Al= 2AlCl3+ 3H2 (
burbujas)
La comparativa con la reacción
del dicromato con la moneda de Cu, marca unas
diferencias muy notables