
Fig.1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
ALUMINIO E HIDRÓXIDO SÓDICO
Hidróxido sódico 2N y
polvo de aluminio
Trabajando como en prácticas anteriores, con un poco de aluminio en polvo y una gota de hidróxido sódico 2N(fig.1), que reacciona en frío, lentamente al inicio (fig. 2, y 3), con una pequeña producción de hidrógeno. A los 10 minutos, la reacción se hace mas violenta, atacándo el aluminio, con desprendimiento de hidrógeno de forma espectacular (fig.4-5-6). Las burbujas se van haciendo mas grandes, (fig 7-15), formándose aluminato sódico.

Fig.1
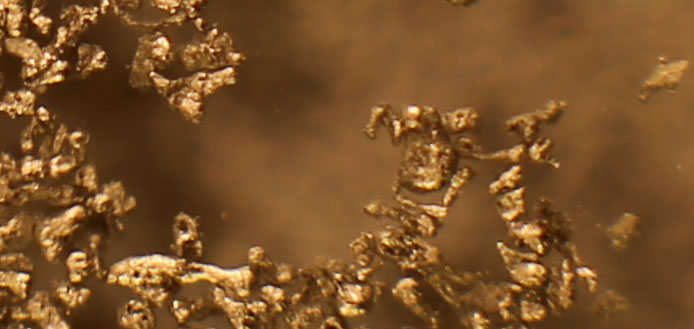
Fig.2

Fig.3

Fig.4

Fig.6 (detalle)

Fig.11

Fig.7

Fig.8
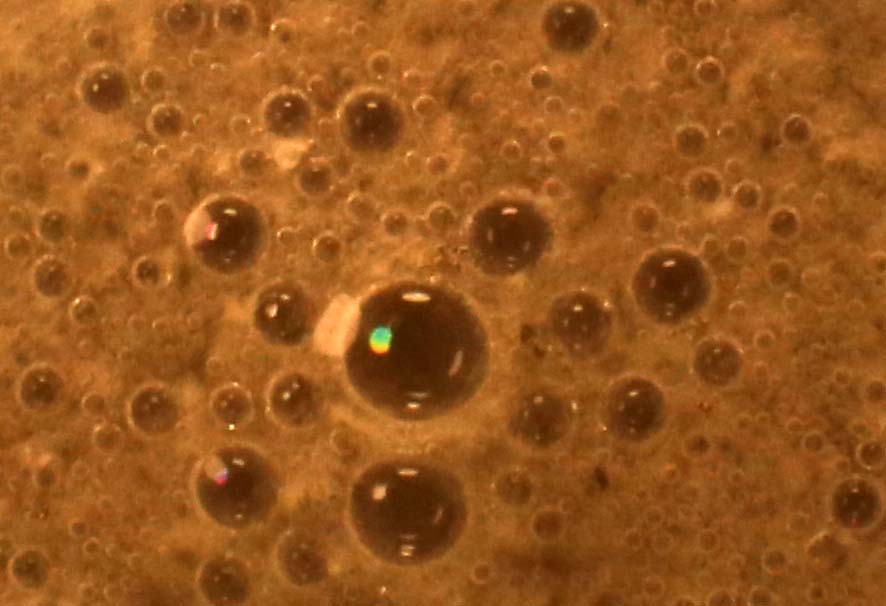
Fig.9 (detalle)

Fig.10
Las reacciones químicas que se producen son redox en medio básico ocasionando aluminato sódico e hidrógeno
REDUCC: 2H2O+2NaOH + 6e- = 3H2 + 2Na++4O2-
OXIDAC: 2Al - 6e = 2Al3+
______________________________________________
2H2O +2NaOH+2Al= 3H2(gas)+
2NaAlO2

Fig.12

Fig.13

Fig.14

Fig.15

Fig.5