ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
TQ66-Orgánica8
ISOMERIA ORGÁNICA 4. ESTEREOISOMERIAS.ISOMERÍA ÓPTICA
10.141. Pasteur, en 1860, publica un
trabajo:”Investigaciones sobre la disimetría molecular de los productor
orgánicos naturales”, en el que explica que la actividad óptica de ciertas moléculas
orgánicas, t, que había sido descubierto por Biot en 1815, se debía a la
asimetría molecular de dichas moléculas, y esta asimetría se caracterizaba por
que en el espejo formaba imágenes no superponibles, y al carbono que producía
esta asimetría se le llamó carbono asimétrico. Ya en 1848 Pasteur, para
explicar las propiedades ópticas de los ácidos tartáricos, supuso una
estructura espacial con base en un
tetraedro irregular, para justificar la asimetría a la que atribuía dichas
propiedades, separándolos en dextrógiros (d o +) y levógiros (l o -) según desviaran la luz polarizada a derecha o a
izquierda. Sin embargo podría ocurrir que con 2 o mas carbonos asimétricos, no tuviera isomería óptica por compensación interna de
las desviaciones, al formarse planos de simetría. Como ocurre con el ácido
tartárico o 2,3-dihidroxibutanodioico, que debería tener un número de carbonos
asimétricos (unidos a 4 átomos o grupos diferentes de:
a) 1 b)
2 c) 3 d) 4
Y dado que el número de isómeros ópticos depende de ellos, (2n,
siendo n el número de carbonos asimétricos), debería tener un número de
isómeros ópticos de:
a)3 b)4 c)9 d) 6
10.142. El 22 de diciembre de 1874, Vant’Hoff,
había publicado una breve reseña de doce
páginas en holandés, que le sirvió como tesis doctoral titulada “Propuesta para la proyección en el espacio
de fórmulas ahora en uso en la química”, que pasó desapercibida en el mundo
científico aunque fuera calificada con “suma
cum laude” ; tenía 22 años. En el documento del año siguiente, en francés,
dice: “Esta teoría está de acuerdo con
los hechos (viendo el número de isómeros predichos), si se consideran las afinidades del carbono dirigidas
hacia los vértices de un tetraedro, en el que el carbono está en su centro…
cuando las cuatro afinidades del carbono están satisfechas por cuatro grupos
univalentes diferentes, se producen dos o mas tetraedros diferentes, uno de los cuales es imagen del otro, no siendo
superponibles”. Aquí estaba la clave de la llamada isomería óptica, la
existencia de carbonos asimétricos para justificar las imágenes especulares. Un
carbono asimétrico debería tener sus afinidades (ahora serían valencias), unidas a 4 elementos o
grupos diferentes. El hidrocarburo saturado no cíclico de menor masa molecular capaz de producir isómeros
ópticos sería el:
a) 2-metilhexano b)
2-metilpentano c) 3-metilhexano d)
3-metilpentano
mientras que si fuera no saturado sería el
a) 3-metil-1-penten-4-ino b)
3-metil-1,4-pentadieno
c) 3-metil-4-penten-1-ino d)
2-metil-1,4-pentadieno
10.143*. Al mes de la aparición del trabajo de van’t Hoff, Joseph Le Bel, ayudante de Wurtz en París, expresó la misma argumentación para
justificar la actividad óptica, agregando la posibilidad de la compensación
interna (forma meso), para el caso de su carencia, por existir un plano de
simetría. Por eso el ácido tartárico 2,3-dihidroxibutanodioico, puede que no
tenga actividad óptica, pese a poseer 2 carbonos asimétricos porque:
a) Tiene un plano de simetría
b) Un carbono asimétrico es dextrógiro y el otro levógiro,
por igual
c) Existe una mezcla del dextrógiro y del levógiro
d) Tienen asimetría molecular
10.144. Cuando
se obtiene un 50% de isómero dextrógiro y otro 50% del levógiro, en la mayoría
de los procesos la mezcla no tendrá
actividad óptica porque se compensan las desviaciones (compensación externa), y
se denominó racémica, ya que se descubrió en el tártaro del vino, cuando viajaba Pasteur por
la región vinícola de Baviera. Por este motivo cuando se obtuvo el ácido
2-hidroxipropanoico se encontró que no tenía actividad óptica porque:
a) Se había obtenido una mezcla racémica
b) Había dos carbonos asimétricos que compensaban sus desviaciones
c) Se había obtenido una forma meso
d) No había asimetría molecular
10.145. Cuando en una molécula hay dos carbonos
asimétricos puede ocurrir que en las
diferentes configuraciones desvíen de
forma opuesta pero diferente la luz polarizada. Cuando esto ocurre se dice que
son:
a) Enantiómetros b)Diasterómeros c)Mesómero d) Isómeros conformacionales
10.151. En 1863, Wislicenus,
sugirió una disposición espacial de los átomos en el ácido láctico o
2-hidroxipropanoico, para explicar la isomería óptica. Aplicando la regla
secuencial dada, el ácido láctico formulado sería un:
a) R-láctico b)
S-láctico c) Ninguno de los dos
10.152. El único hidrocarburo de cadena abierta y de fórmula C6H12,
con isomería óptica será el:
a) 3-metil-1-penteno
b) 3-metil-2-penteno
c) 2-metil-2-penteno
d) 2-metil-3-penteno
10.153.La combustión de 4g de cierto hidrocarburo lineal, proporcionó
12,32g. de dióxido de carbono. Si su peso molecular es 100, el único compuesto
con estas características que posea isomería óptica será el
a) 3,3-dimetilpentano b)
3-metil-1-penteno c)
3-metil-1-pentino d)
3-metilhexano
Datos: C=12; H=1
10.155 Un
compuesto orgánico de C,H y O, lineal tiene un 22,22% de O, un doble enlace y
sólo un grupo alcohol, un isómero óptico del mismo sería el:
a) 2-buten-2-ol b)2-penten-3-ol c)3-buten-2-ol d)3-penten-1-ol
Datos: C=12; H=1; O=16
10.154.Un compuesto orgánico de cadena
lineal, tiene la siguiente composición centesimal : C=17,82%; H=2,97% ;
Br=79,21%. Sabiendo que 2,09 g.de dicho compuesto gaseoso ocupan a 1atm.de
presión y 177ºC, un volumen de 381,7mL, el único compuesto que en estas
condiciones tiene isomería óptica será el:
a) 1-bromopropano b)1,2-dibromopropano c)1,3-dibromopropano d)1,3-dibromobutano
M.AT: Br,80 / C,12 / H,1. R=0,082atm.L.K-1.mol-1
10.156. 2g. de un compuesto orgánico de cadena lineal, producen por combustión
4,89g de dióxido de carbono y 2g de agua. Si su masa molar es 72g/mol, y
sabiendo que tiene isomería óptica dirás que se trata del:
a) 2-metil-1-butanol b)2-metil-2-propanol c) 3-buten-2-ol d) 2-buten-2-ol
Datos: C=12; H=1; O=16
10.157. La composición de un compuesto orgánico lineal
con características ácidas da 60% de C, 32% de oxígeno y el resto hidrógeno. Si
su masa molar es de 100, y tiene isomería óptica, el compuesto en cuestión será el:
a) 2-metil-3-butenoico b)
2-metil-2-butanoico c)3-pentenoico d) 4-pentenoico
Datos: C=12; H=1; O=16
10.158. Un compuesto orgánico de cadena lineal
presenta la siguiente composición: C=66,67%- H=11,11% - O=22,22. Si tomas 2 g.
del mismo y lo calientas hasta 127ºC ocupa en fase gaseosa a 0,9 atm. de presión
1,01L si presenta actividad óptica . Con estos datos dirán que el único compuesto
que en presenta actividad óptica será el:
a) 2-metil-1-butanol b)2-metil-2-propanol c) 3-buten-2-ol d) 2-buten-2-ol
Datos: C=12; H=1; O=16. R=0,082atm.L.K-1.mol-1
R=0,082atm.L.K-1.mol-1
10.159. 4g de un aldehido de
cadena lineal, producen por combustión 4,186g de agua. El único posible con isomería óptica sería el:
a) 3-metilpentanal b)
2-metilbutanal c) 4-metilpentanal d) 3-metilbutanal
DATOS : MASAS ATÓMICAS: C,12- H,1-O,16
R=0,082atm.L.K-1.mol-1
10.160. Dispones de un compuesto orgánico de C,H y O
del que sabes que contienen un 58,82% de carbono y un 31,37% de oxígeno.
Además 2g del mismo disueltos en 100mL de agua producen una disolución que
hierve a 100,102ºC, a presión normal. El único compuesto con esas
características capaz de tener 4 isómeros ópticos es el:
a) 3-metilbutanoico b)
3-metil-2,3-butanodiol
c) 2,3-pentadieno-2,3-diol d) 4-penteno-2,3-diol
DATOS : MASAS ATÓMICAS: C,12- H,1-O,16. Constante ebulloscópica del agua =0,52 K.kg.mol-1

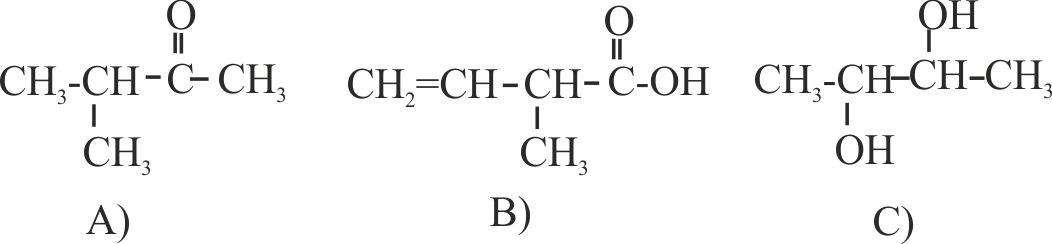
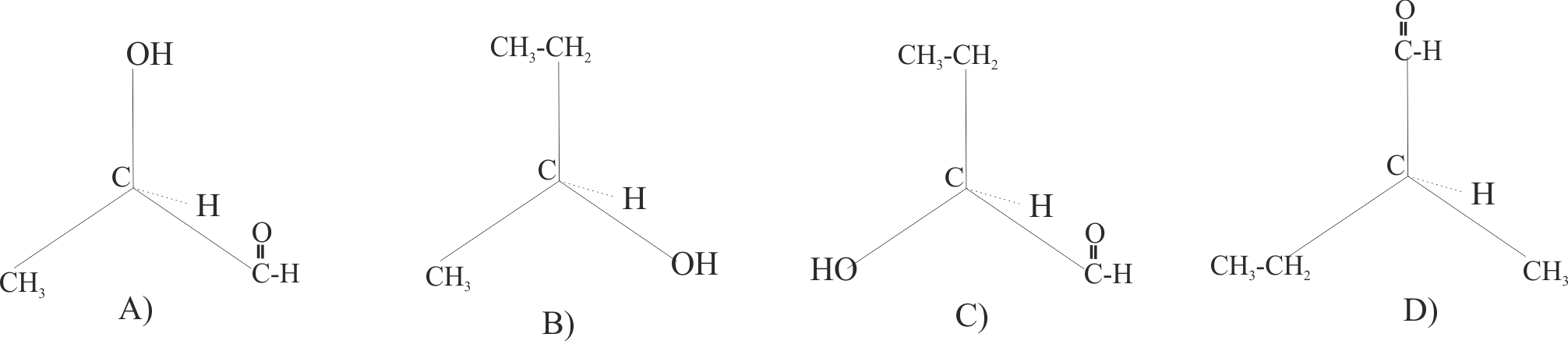
10.146. De
las moléculas orgánicas dadas dirás que:
1) Puede que no tenga actividad óptica
la: a)
A b) B c)C d)
Ninguna
2) No tienen un carbono asimétrico, la : a) A b)
B c) C d) Todas
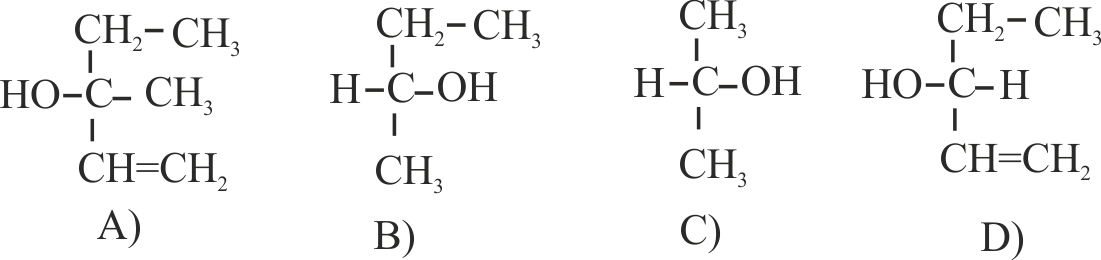
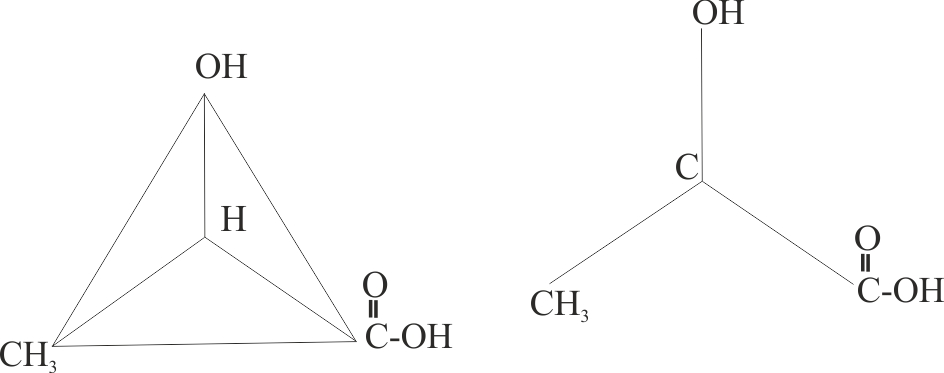
10.147. En 1891, Fischer, propuso unas formas de
proyección del tetraedro del carbono sobre un plano, para explicar mejor la
isomería óptica, partiendo del gliceraldehido dextrógiro (aplicándolo luego a los monosacáridos) escribió en el plano, el
carbono asimétrico, con el grupo OH a la derecha, de esta forma todos los compuestos
que en el primer carbono asimétrico el OH está a la derecha serán de la familia
D, y lo contrario la familia L, letras que no tienen nada que ver con el
carácter dextrógiro (d o +), o levógiro (l o -) de la sustancia. De esta forma, de las cuatro sustancias dadas será de
la familia D
a) La C b)
La A c) La D d) La B
10.148. El término de estereoisomería había sido propuesto por Victor Meyer ya en 1890, para sustituir el “química en el espacio” de van’t Hoff (estereo,
sólido o cúbico en griego, en el sentido de espacial). El monoalcohol mas sencillo con isomería óptica será el:
a) 2-metil-1-butanol b)
2-butanol
c) 2-propanol d) 2-metilpropanol
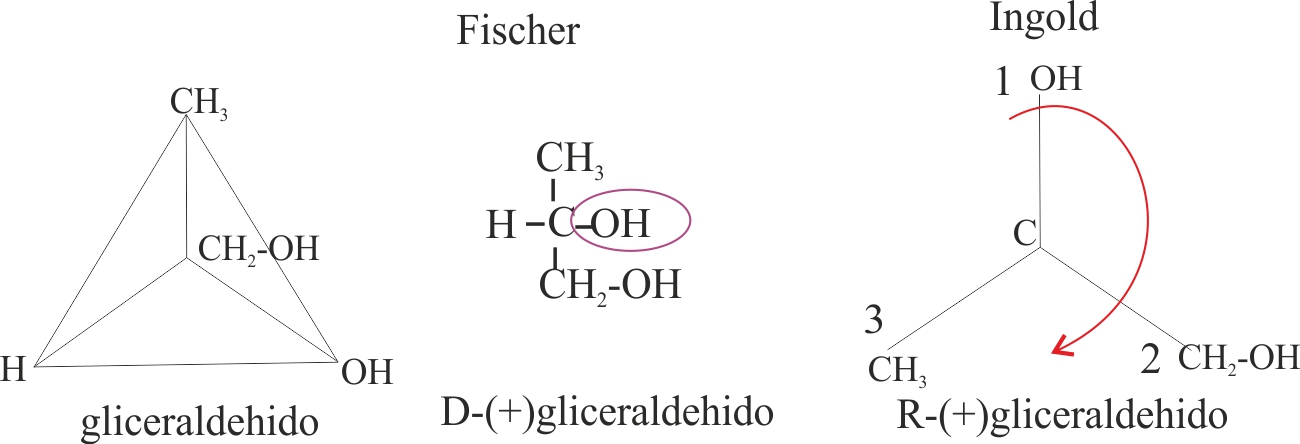
10.150*. Las normas de formulación de isómeros
ópticos de Fischer, partían de su estudio de los monosacáritos,
y no tenían nada que ver con la desviación de la luz polarizada hacia derecha o
izquierda, aunque posteriormente se descubriera que el D-gliceraldehido,
era dextrógiro (d o +).
Las reglas secuenciales, fueron mas generales, aplicadas a todos los compuestos con isomería
óptica, pero tampoco tenían relación con la actividad óptica, como se ve en la
figura, aunque el R-gliceraldehido desvíe hacia la
derecha la luz polarizada, según eso podrás decir que:
a)
Un isómero D, podría desviar hacia la
izquierda la luz polarizada
b)
Un isómero L, podría desviar hacia la
izquierda la luz polarizada
c)
Un isómero R, podría desviar hacia la derecha
la luz polarizada
d) Un isómero S, podría desviar hacia la derecha la luz polarizada
10.149*. La asimetría molecular responsable de las propiedades ópticas
de determinadas sustancias, fue denominada quiralidad por lord Kelvin en 1884, término que fue retomado por Kahn, Ingold y Prelog, cuando se
establecieron entre 1951 y 1956, las reglas secuenciales en la nomenclatura de
los isómeros ópticos. Su origen está en el griego keir,
mano, dado que los enantiómeros (enantio, opuesto en griego) son imágenes
especulares, tal como una mano lo es de la otra. Las reglas, llamadas secuenciales,
implican un tipo de nomenclatura de isómeros ópticos que difiere de la R/L de
Fischer, conservando la estructura tetraédrica del carbono asimétrico en el
centro del tetraedro, y visualizando los tres átomos de mayor número atómico en
los 3 vértices del plano del papel (el cuarto estaría hacia atrás), se seguiría
el orden de prelación de mayor a menor número atómico, si este orden de
recorrido, implica un sentido horario el isómero será rectus (R), o sea hacia la derecha; si antihorario , sinister (S)
o sea hacia la izquierda, de esta forma de los compuestos dados serían S, los : a) A b)
B c) C d)D