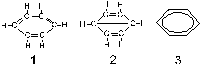
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
TEST
DE QUÍMICA CON ENUNCIADOS FORMATIVOS
ENLACE COVALENTE 2
23. Inicialmente se introdujo el término “híbrido de resonancia”, propuesto por Arndt en 1924, para explicar el comportamiento de la molécula de benceno, debido a que explicaba con un supuesto e irreal movimiento oscilante de los electrones en la justificación de la aparición de sus dobles enlaces, en las fórmulas de Kekulé. Sin embargo actualmente se concibe la resonancia como:
a) La oscilación de los electrones en un enlace
químico
b)
La posibilidad de que la estructura electrónica de una molécula se pueda describir
por la contribución de varias configuraciones distintas
c) La necesidad para justificar el comportamiento
químico de algunas moléculas
d) Una nueva teoría de enlace químico
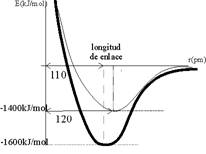
24. Si te dan el esquema de la figura para representar la energía de enlace real de una molécula (energía experimental) y la que corresponde a la fórmula que escribes para ella (energía teórica), sabiendo que la longitud de un doble enlace es de 120 pm ( pico metros =10-12m), podrá decir que :
a)
Que existen otras fórmulas para la misma molécula
b)
Que tiene la energía de resonacia de 200kJ
c)
Que las fórmulas no descritas deben tener algún
triple enlace
d)
Que no sigue la ley del octeto de Lewis
Indica lo lo que no sea
25. Aunque Abegg había anunciado
la necesidad de los elementos de rodearse de 8 electrones, ya en 1904, puede
considerarse a Lewis, padre de la teoría del octeto, y del enlace covalente,
al introducirla desde
a) Tiene triples enlaces
b) No cumple la teoría de Lewis
c) Tiene enlaces sencillos
d) Tiene formas resonantes con triples enlaces
26*. Las moléculas resonantes se caracterizan por
poseer propiedades diferentes de las derivadas de sus aparentes configuraciones
electrónicas teóricas. Muchas veces a una molécula resonante se la compara
con ejemplos faunísticos de un animal híbrido real hipotéticamente obtenido
a partir de formas irreales, ya que realmente no existen. Así Huehey la asemeja
a un halcón, posible híbrido mitológico del dios egipcio ra (el sol), con
cabeza de halcón, con una arpía (cara de mujer y garras de ave de rapiña).
Estos símiles se hacen porque:
a) Las fórmulas de moléculas resonantes no existen como moléculas independientes
b) No se pueden formular sino en conjunto
c) Son todas ellas las que indicarían el comportamiento real de la molécula
d) No se pueden formular
27. Aunque en muchos libros de texto leerás que el benceno deriva del griego, no es así, sino que procede del árabe lubenyawi, por pérdida del prefijo. La palabra venía a significar "incienso de java" pues extraído de resina era empleado por los malayos para venerar sus dioses. Esa especial aromaticidad tiene su origen en otra aromaticidad, con significado especial químico, característica de compuestos bencénicos y derivados. Esta aromaticidad se basa en:
a) El olor de los compuestos
b) La posibilidad de que formen moléculas resonantes
c) La deslocalización molecular en un anillo
d) La formación de nuevos enlaces
28. Wheland,
conocido químico físico orgánico, profesor de la universidad de Chicago, ponía
como ejemplo de una molécula resonante, el caso de la mula, híbrido del caballo
y de la burra, sin parecerse a ninguno de los dos, posee propiedades de ambos.
A partir
de aquí se empleó la expresión de híbrido de resonancia y el concepto de hibridación
en química. Aunque este ejemplo no es muy correcto, permite recordar lo que es una molécula resonante
y posiblemente hasta qué son sus formas canónicas. De las fórmulas dadas en
la figura adjunta para el benceno, la más representativa es la:
a) 1
b) 2 c)
3
d) Ninguna de ellas
29. El ozono es una forma alotrópica del oxígeno que se llama así por producir un olor característico que se puede apreciar en el ambiente después de una tormenta, con descargas eléctricas, ya que se puede formar así a partir del oxígeno. Sin embargo mientras que la molécula de éste tiene un doble enlace y no tiene resonancia, no ocurre lo mismo con el ozono que:
a) Tiene una geometría lineal
b) Presenta formas resonantes con 2 estructuras contribuyentes
c) No cumple la ley del octeto
d) Los átomos de oxígeno están en una hibridación sp3
30. Cuando humea un volcán, el aire a su alrededor se hace sofocante, ello es debido a la formación de dióxido de azufre. Sin embargo hace 2000 años, se consideraría un proceso de culto divino, en el que Hafaistos (Vulcano de los romanos), sepultado por Zeus (Júpiter), en la Tierra, ofrecía sus presentes a los dioses del olimpo. Por eso el azufre o zufre, deriva no del árabe, sino del griego zeion, que lo hace de Zeus. Este óxido presenta gran estabilidad, de su estructura electrónica podrá asegurar que:
a) Tiene una geometría lineal
b) Presenta formas resonantes con 2 estructuras
contribuyentes
c) Presenta dos dobles enlaces
d) El átomo de azufre está en
una hibridación sp3
31. La molécula impar más sencilla es la conocida del óxido nítrico (monóxido de nitrógeno), NO, molécula del año 1992 por sus implicaciones biológicas, estudio que les valió a sus investigadores, el Nobel de Medicina de 1998. Esta molécula es difícil de describir electrónicamente, porque dispone de un electrón sin pareja (electrón impar), con lo cual no sigue la teoría de Lewis. Precisamente este electrón impar es lo que hace que sea paramgnética y muy reactiva, de ahí sus propiedades, ya que reactiva los sistemas musculares, impidiendo el infarto de miocardio. La justificación electrónica de su estructura implicaría que la unión entre el oxígeno y el nitrógeno sería:
a) trielectrónica
b) con doble enlace
c) con estructuras resonantes
d) covalente polar
32. Aunque el N2O fue descubierto por
Priestley en 1772, fue divulgado por Davy y empleado como anestésico. Por
sus efectos hilarantes fue llamado "gas de la risa”, es una molécula,
con características de resonante. De
las formas resonantes que la describen podrá decir que:
a)
No tienen triples enlaces
b) Sólo tienen dobles enlaces
c)
Sólo tienen enlaces sencillos
d) Todas cumplen la ley de Lewis
a)
Sus nombres derivan del tipo de superposición orbital al realizar la CLOA
b)
El HOMO de una molécula diatómica honuclear con 14 electrones es un OM pi
2p
c)
El LUMO de una molécula diatómica homonuclear con 10 electrones es un OM sigma
2p
d)
El orden energético de los OM varía según el número atómico de cada elemento
Indica lo que no sea
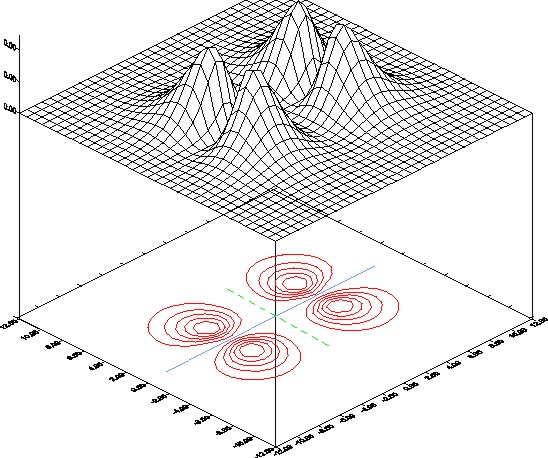
34. El dibujo que te dan correspode a la imagen computorizada
de un orbital molecular, que suele dibujarse por la proyección sobre el plano.
Analizada dicha imagen se podría asegurar que :
a)
Se dibuja un OM sigma
b) Se dibuja un OM pi
c)
Tiene un plano nodal
d) tiene 2 planos nodales
35. Lewis consideró impropio el nombre de enlace covalente, propuesto por Langmuir en 1919, denominándolo homopolar, en oposición al heteropolar aplicado por Kossel a los compuestos iónicos, sin embargo aplicó un curioso nombre a las moléculas en las que no se cumplía exactamente la regla del octete, como la del óxido nítrico NO. La teoría de OM, justifica plenamente su estructura ya que el electrón número 15, semillena un OM:
a)
sigma 2p enlazante
b) sigma 2s antienlazante
c)
pi 2p enlazante
d) pi 2p antienlazante
36. Aunque no lo crea, el oxígeno es el elemento químico que mas nombres ha tenido en la historia, su descubrimiento se lo atribuyen científicos de tres países diferentes (Inglaterra, Francia y Suecia) y su molécula que es paramagética, en estado líquido, es azul.La molécula O2, puede ganar y perder electrones, formando estructuras O2-, O2-2, y O2+1. De todas ellas la mas estable dirá que es la:
a) O2 b)
O2- c)
O2+ d)
O2-2
mientras que la más paramagnética
será la:
a) O2 b)
O2- c) O2+ d) O2-2
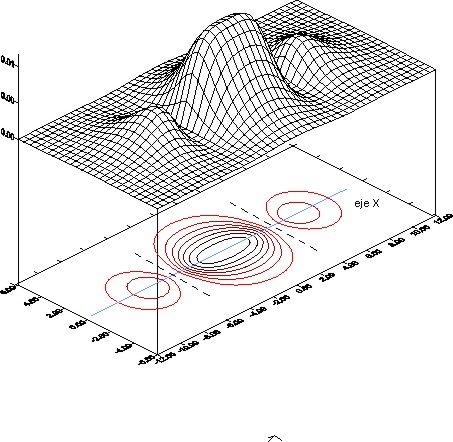
37. Si le dan el dibujo de la formación de un OM, podrá asegurar que se trata de un OM:
a)
Del tipo pi
b)
Antienlazante
c)
Formado por la CLOA de 2OA px
d)
Formado por la CLOA de 2OA s
38. Las moléculas de los halógenos presentan diferente color, desde la de cloro que es verdoso (cloro significa verde en griego), hasta la de bromo que es rojiza y la de yodo, violeta (yodo significa violeta en griego), y el color depende de la diferencia energética entre el HOMO y el LUMO, de dichas moléculas que en dichas moléculas:
a) El HOMO es un pi 3p enlazante
b) El LUMO es un pi3p antienlazante
c) La separación entre ambos aumenta con el
número atómico
d) La separación entre ambos disminuye con
el núero atómico
39. El cloro es un elemento muy electronegativo como debe saber, y por lo tanto con capacidad para atraer electrones, sin embargo la molécula de cloro tiene una energía de enlace de 237 kJ/mol, pero si pierde electrones, su energía de enlace es de 420,8 kJ/mol. Este hecho aparentemente contradictorio es debido a:
a) El orden de enlace aumenta
b) El orden de enlace disminuye
c) El HOMO varía
de uno a otro
d) El LUMO varía de uno a otro
40. El estudiante de enseñanzas medias, asocia el nombre de Rutherford, al descubrimiento del núcleo atómico, el modelo atómico planetario, e incluso ala radiactividad y las reacciones nucleares. Sin embargo siglo y medio antes, vivió otro Rutherford, este inglés, que descubrió uno de los elementos indirectamente vitales para el hombre: el nitrógeno, que es el componente más abundante de la atmósfera. De las formas que te dan para la molécula de nitrógeno: N2,N2-,N2+,y N2-2. De todas ellas la más estable dirá que es la:
a) N2 b)
N2- c)
N2+ d)
N2-2
mientras que la más paramagnética
será la:
a) N2 b)
N2- c) N2+ d) N2-2
41. Aunque posiblemente no te lo creas, la segunda
molécula más abundante en el universo, después de la de hidrógeno, es la de
un veneno nato para el hombre, el monóxido de carbono, responsable de la emisión
de radiación interestelar en la banda de 11metros. De su molécula tratada
por OM, podrás asegurar que:
a) Forma un doble enlace
b)
Su HOMO es un OM sigma 2p
c) Su LUMO es un OM pi enlazante
d) Es una molécula paramagnética
42. El monóxido de carbono, fue denominado por Priestley,en 1772, gas silvestre, porque difería del gas inflamable común (hidrógeno), y ardía con una llama azul. La distancia de enlace entre sus átomos es de 124pm, que se encuentra mas cerca a la del triple enlace entre el C y el oxígeno,120pm que a la del doble enlace,134pm, lo cual se explicaba por resonancia. Sin embargo la teoría de OM.:
a) Solo tendría dobles enlaces
b) Sólo tendría triples enlaces
c) No tendría ni dobles ni triples enlaces