ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
161. En 1833, Faraday propone que “La acción química de una corriente eléctrica es directamente proporcional a la cantidad de electricidad que pasa”.Eso quiere decir que, cuando en un cátodo se depositan 6,35g de cobre, en la electrolisis de una disolución de sulfato de cobre, han tenido que circular por el mismo una cantidad de carga eléctrica en culombios de:
a) 2,0104
b)1,0. 104
c) 1,9.104
d) 9,6.103
DATOS. Masa atómica del cobre
63,5. Faraday=96500C
162. El texto original de la segunda ley de Faraday decía así: “Para una cantidad constante de electricidad, la cantidad de acción electroquímica es siempre equivalente a un efecto químico tipo basado en la afinidad química ordinaria”.Por ello, la intensidad de la corriente necesaria para depositar 2 equivalentes gramos de cualquier sustancia después de una hora de electrolisis es aproximadamente en amperios de:
a) 53,6 b) 80,4 c) 26,8 d) 91,2
DATOS. Faraday=96500C
163*. También en 1833, Faraday explica su segunda ley con las siguientes palabras::”Los átomos de los cuerpos que son equivalentes entre sí, en su acción química ordinaria llevan cantidades de electricidad asociada a ellos”. O sea que los pesos de los iones depositados en los respectivos electrodos, eran proporcionales a:
a) Al tiempo de circulación de la corriente
b) A la conductividad eléctrica de la disolución
c) A la masa atómica de los iones y a su carga
d) A la intensidad de la corriente que circulaba
DATOS. Faraday=96500C

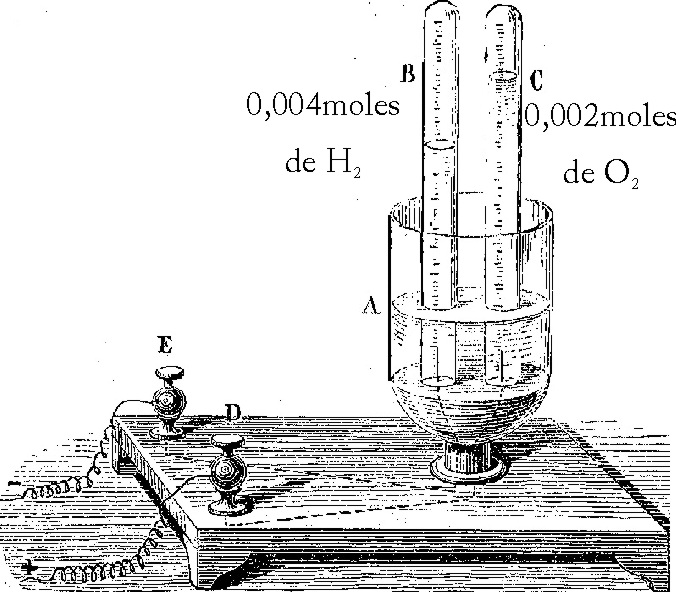
164. Si se quiere que se realice la reacción de descomposición del agua en un voltámetro tal como indica la figura, hacen falta que circulen:
a) 380C b) 1520C
c) 770C d) 3000C
DATOS. Faraday=96500C
a) La corriente circula de D a E
b) La corriente circula de E a D
c) B es el cátodo de la celda electrolítica
d) A contiene agua destilada
166.En 1834, Faraday descubrió que las sales fundidas obedecían las leyes de la electrólisis. Así, el cloruro de estaño(II), dio estaño en el cátodo y cloruro de estaño(IV) en el ánodo, esto era debido a que en el ánodo:
a) Nunca debería aparecer cloruro de estaño(IV), así que fue un error.
b) El Sn(II) se cargaba a Sn(IV)
c) Reaccionaba el cloro(gas) producido con el cloruro de estaño(II), oxidándolo
a estaño(IV)
d) El Sn(II) se descargaba a Sn(IV)
167*.El Faraday se definió como la carga transportada por un mol de electrones, según eso, para calcular su equivalencia en el sistema internacional haría falta:
a) Conocer la carga de un electrón en el SI
b) Saber el tiempo en el que actúa
c) Conocer la equivalencia del culombio
d) Que te den el número de Avogadro
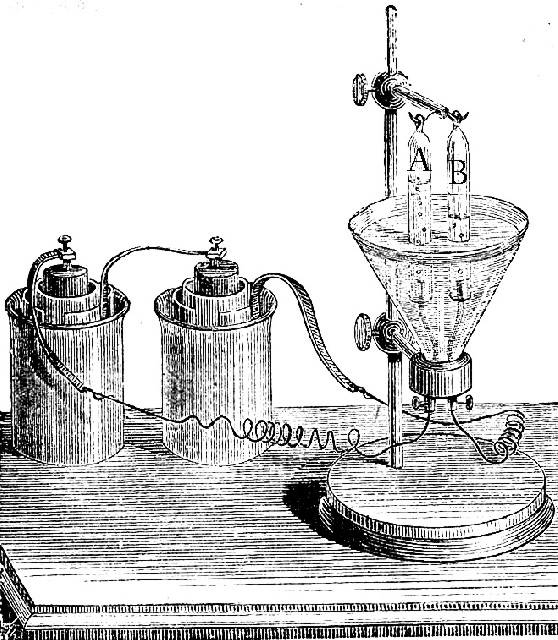
168. La foto de la figura corresponde a la electrólisis de agua acidulada, por la cual circula la intensidad de la corriente de 50A, durante 5 minutos. En este momento la temperatura del experimento es de 18ºC y la presión atmosférica 700mmHg Según eso podrás asegurar que se recogen aproximadamente:
a) En A 0,1L de H2
b) En B 0,2L de O2
c) En A 0,1L de O2
d) En B, 0,2L de H2
DATOS. Faraday=96500C. R=0,082 atm.L.K-1mol-1
Presión del vapor de agua a 18ºC=15,48mmHg
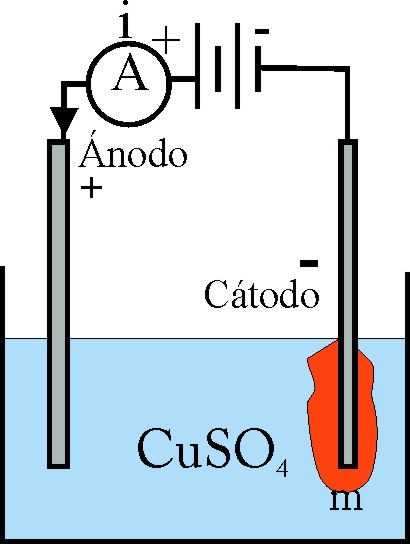
169. En el esquema dado, sobre la electrólisis de una disolución de sulfato de cobre(II), y marcando A, 10A podrás decir que al cabo de 10 minutos m será aproximadamente en gramos:
a) 2 b) 1 c) 3 d) 4
DATOS. Masa atómica del cobre
63,5. Faraday=96500C
170. Si en la electrolisis anterior, disponías de 1 litro de disolución sulfato de cobre 1M, al cabo de dicho tiempo será:
a)1,1M b)
0,97M c), 0,91M d)1M
171. Aunque no aparece en los
libros de Química, no fue Faraday el único y primero en enunciar las leyes
de la electrólisis, ya que el italiano Carlo Matteucci, las publicó en francés
en los Annales en octubre de 1834 (sólo unos meses después de Faraday), de
forma completamente independiente, empleando procedimientos distintos. Una
de sus conclusiones la redactó así :”El
paso de la corriente eléctrica a través de diferentes soluciones metálicas,
produce una acción química en la cual las cantidades de metales reducidas
y separadas de dichas disoluciones son variables y siempre se producen en
la misma relación de los pesos equivalentes de dichos metales”. Sin embargo
no propuso como Faraday una tabla de pesos equivalentes, o tabla de iones,
en muchos casos contraria a las opiniones de la época. Así para el ácido sulfúrico
propuso como peso equivalente 40, cuando en realidad debería ser:
a) 98 b) 64 c)32 d) 49
DATOS: Masas atómicas: S=32 ( había tomado 16), O=16 (había tomado 8), H=1
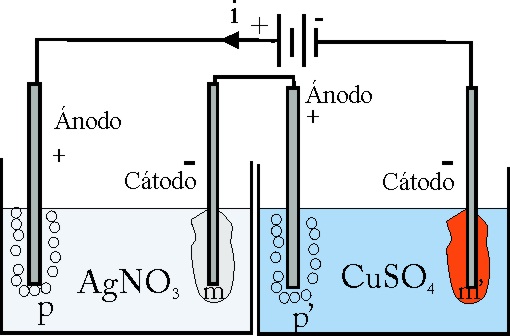
172. En el dispositivo de la figura, cuando una determinada intensidad i, durante un tiempo t, la relación entre m y m’ dependerá de:
a) El tiempo t
b)La intensidad i
c)Sólo de los pesos atómicos de Ag y Cu
d)Sólo de los pesos equivalentes de Ag y del Cu
173. Una corriente pasa sucesivamente a través de agua acidulada y de una disolución de nitrato de plata. Si después de 8 horas, el volumen de hidrógeno desprendido ocupa 391cm3 a 15ºC y 752mmHg. La cantidad de plata depositada en el cátodo sería en gramos, aproximadamente:
a)1,5 b)3,5 c)2,5 d)4,5
DATOS. Masa atómica de la plata
107,9. Faraday=96500C. R=0,082 atm.L.K-1mol-1
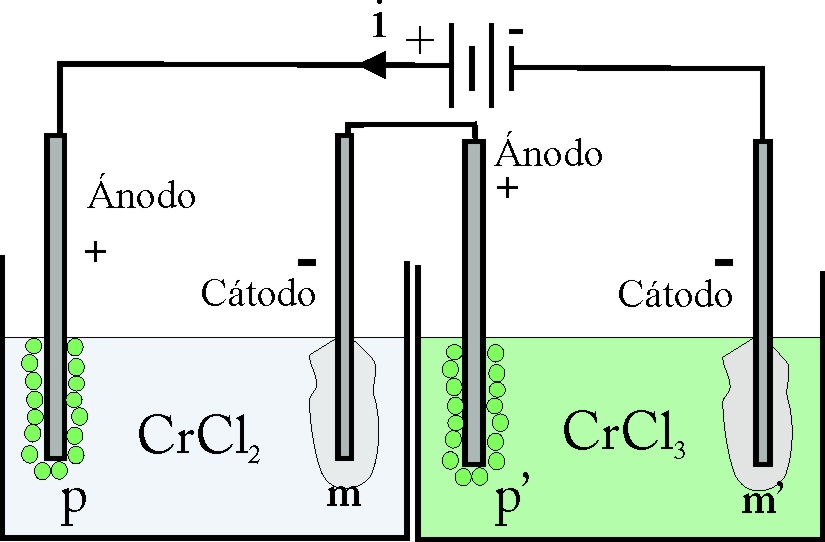
174. En el dispositivo de la figura, la relación entre m y m’ será:
a)1 b)1,5
c) 0,66 d)2
DATO: Faraday=96500C.
175. En el test de la figura anterior, la relación entre los volúmenes de gases p y p’ que se desprenden en el ánodo, será:
a)1 b)1,5
c) 0,66
d)2
Dato: Faraday=96500C.
176.Durante la electrólisis del nitrato de un metal en disolución acuosa entre electrodos de platino, se depositaron 0,5613g.de metal al mismo tiempo que se recogían en el ánodo 103,6 cm3 de oxígeno a 18ºC y 746mmHg. Por los datos dados dirás que la valencia del metal será:
a) 1 b) 2 c) 3 d) 4
DATO: Peso atómico del metal =65.
Faraday=96500C.
177*. Dispones de un volumen determinado de disolución 2M de sulfato de cobre(II), y la sometes a electrólisis:
a) En el cátodo se desprenderá hidrógeno
b) En el ánodo se desprenderá oxígeno
c) Si se pretende obtener 50L de oxígeno en condiciones normales, el volumen
de disolución mínimo a emplear será 1L
d) El tiempo necesario para obtenerlo con una corriente de
10 A será de aproximadamente un día
DATO: Volumen molar 22,4L/mol.
Faraday=96500C.
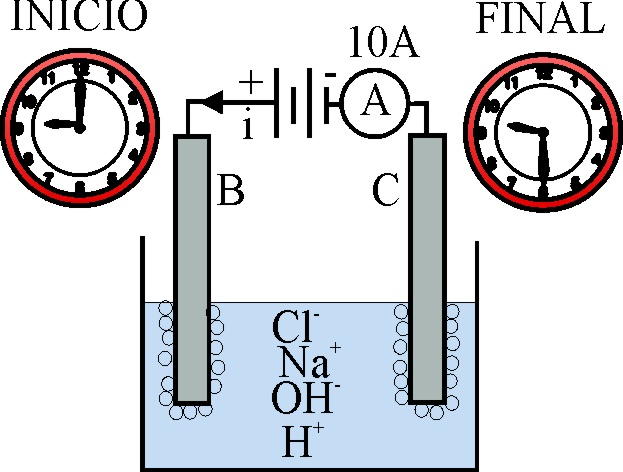
178*.Tal como indica la figura, dispones una cubeta con una disolución de cloruro sódico, en la que introduces dos electrodos unidos a una batería y un amperímetro. Conectas el sistema a hora de inicio, y lo paras a la hora final. Se propone:
a)En B se desprende H2
b)En C se descarga preferentemente oxígeno
c)El volumen de gas desprendido en C en c.n. es 4L
d)El pH de la disolución aumenta en 5 unidades
DATOS: F=96500C.
179*.Si preparas dos litros de una disolución 1M de cloruro sódico y la dispones en una cubeta electrolítica, sometiéndola durante media hora a una corriente de 10A,
a) En el cátodo se deposita sodio
b) El volumen de gas desprendido en ese tiempo y condiciones normales
sería 4L
c) La concentración de la disolución en la cubeta al cabo de ese tiempo
sería 0,9M
d) El pH de la disolución final sería 12
DATOS: F=96500C.
180*. Se disponen de 2,5g de sulfato de cobre(II) pentahidratado y se disuelven hasta obtener un litro de disolución, que llena una cuba electrolítica. Se hace pasar una corriente de 2A, durante 10 minutos.
a) En el ánodo se producirá
oxígeno
b) La concentración final
de sulfato de cobre en la disolución será la mitad de la inicial
c) El volumen de gas
desprendido a 730mmHg y 25ºC, será
aproximadamente 80mL
d) El pH final será menor
que 7
Datos: F=96500C.
R=0,082atm.L/K.mol.
Masa molar del sulfato de cobre(II)pentahidratado=249,6g.mol-1: