Foto 2
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA

Foto 2

Foto 1
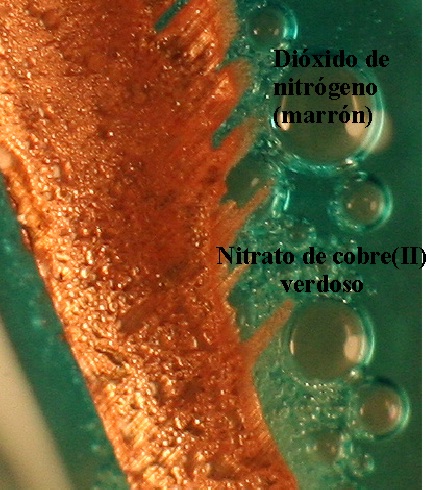
121*. En las fotos se muestra la reacción entre el ácido nítrico concentrado y el cobre, indicándose los productos de la reacción. La observación de las mismas y el ajuste correspondiente, te hará decir que:
a) El potencial de reducción
del Cu(II) es superior al del N(V), en las semirreacciones redox correspondientes
b) El ácido nítrico disuelve el cobre
c) Cuatro moles de ácido nítrico toman 2 moles de electrones
d) El cobre actúa como reductor
122. La representación de la ecuación de Nernst, con la diferencia de potencial producida en un proceso
redox, frente al logaritmo decimal del cociente de la reacción Q, sería de
todas las gráficas dadas
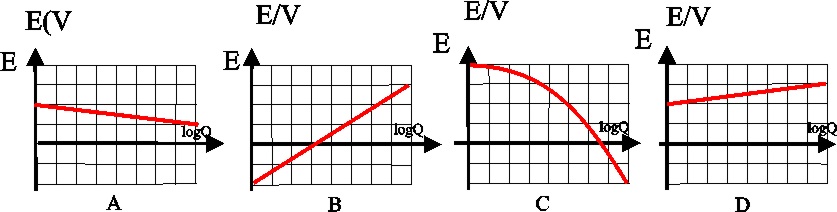
la única correcta, sería la:
a) A
b)B c)C d)D

Foto 1

Foto 2
123*. El dicromato amónico de color naranja (foto1),
es un compuesto inestable que por acción del calor se descompone en óxido
de cromo(III), de color verdoso oscuro (foto 2), y nitrógeno(gas), que al
desprenderse produce la sensación de un volcán, por la gran expansión de las
cenizas, en este caso el óxido de cromo (III). Es una reacción redox característica
en la cual:
a)Por cada mol de nitrógeno
producido se han ganado 6 moles de electrones
b)El nitrógeno del amonio
actúa como reductor
c)Es un proceso redox
interno
d)Cada mol de dicromato
produce 22,4 L de nitrógeno en condiciones normales
124. Dadas las posibles gráficas de variación del potencial de reducción
del hidrógeno con el pH
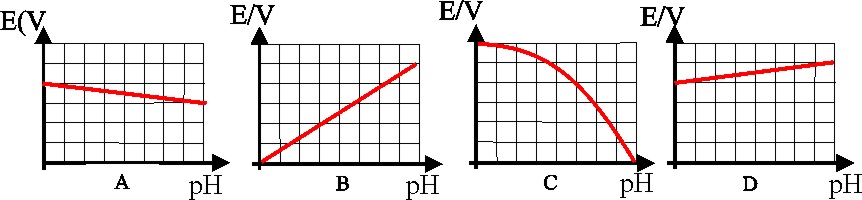
la única que es correcta de todas ellas es la :
a)A
b)B c)C d)D
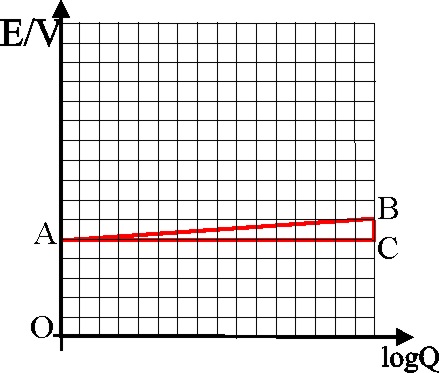
125*. Para la pila Daniell, y en la
gráfica de la diferencia de potencial producida frente al logaritmo del cociente
de reacción Q, que te dan:
a)OA
representaría la diferencia de potencial en condiciones normales
b)AB representaría la variación de
dicha diferencia de potencial
c)BC/AB será 0,029
d) BC será lo que disminuye la diferencia
de potencial con el tiempo
126.En 1870, el físico-matemático norteamericano Gibbs, creó el concepto de energía libre o entalpía libre, como la energía útil de un proceso químico, que además regulaba el sentido en que cualquier reacción debería desplazarse espontáneamente. No solamente es famoso por eso, en su época de estudiante de ingeniería en la universidad de Yale, creo un sistema de tubo de viento tan de moda actualmente para experimentar la resistencia a la fricción de los vehículos, y un freno hidráulico para los mismos, y posteriormente desarrolló el cálculo vectorial en Física. En una pila electroquímica, la variación de energía libre, depende de la diferencia de potencial originada en dicha pila, por eso la pila dada en condiciones estándar generará aproximadamente una energía libre en kilojulios de:
a) -320 b) -212
c) -111 d) -100
DATOS: 1F=96.487C.mol-1
| V |
|
| F2 +2e→2F- |
2,87
|
| PbO2+2e→Pb2+ |
1,68
|
| MnO4-+5e→Mn2+ |
1,52
|
| Cl2+2e→2Cl-
|
1,36
|
| Cr2O7
2+6e→2Cr3+ |
1,33
|
| O2+4e→2H2O
|
1,23
|
| Br2+2e→2Br-
|
1,06
|
| NO3-+3e→NO
|
0,96
|
| Ag+
+e →Ag |
0,80
|
| I2+2e →2I-
|
0,53
|
| Cu2++2e →Cu |
0,34
|
| 2H+ +2e →H2 |
0,00
|
| Pb2++2e
→Pb |
-0,13
|
| Sn2++2e
→Sn |
-0,14
|
| Ni2++2e
→Ni |
-0,24
|
| PbSO4+2e→Pb Fe2++2e
→Fe |
-0,36
-0,44 |
| Zn2++2e
→Zn |
-0,76
|
| Mn2++2e
→Mn |
-1,19
|
| Al3++3e
→Al |
-1,66
|
| Mg2++2e→Mg
|
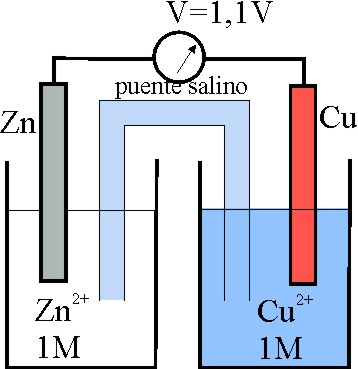
-2,37
|
| Na++e→Na
|
-2,71
|
| K++e→K
|
-2,92
|
| Li++e→Li
|
-3,05
|
127.En la pila de la figura y en condiciones estándar, dadas en la tabla adjunta, podrás decir que la energía libre que generará será aproximadamente en kilojulios:
a)-21
b)-10 c)-51 d)-30
DATOS: 1F=96.487C.mol-1
128.En la pila de la figura y en condiciones dadas (temperatura y presión estándar), podrás decir que la energía libre que generará, aproximadamente será, en kilojulios:
a)-50 b)-100
c)-104
d)-52
DATOS: 1F=96.487C.mol-1
129.La variación de energía libre para la posible reducción del nitrato de plata 4,2.10-6M a plata metálica, con cobre, en una disolución 1,3.10-3M de sulfato de cobre(II), siendo Eo Ag+/Ag=0,779 / Eo Cu2+/Cu=0,35V, será aproximadamente en kilojulios:
a) -80 b) -50 c) -20 d) -40
DATOS: 1F=96.487C.mol-1

130.De forma que en la pila dada H2(p=400mmHg)/Pt(H+=0,01M//Pt(H+=0,001M)/H2 (p=760mmHg), la variación de energía libre será aproximadamente en julios:
a)-5000 b)-10000 c)-2500 d)-1000
DATOS: 1F=96.487C.mol-1
131. En la pila de concentración de la figura, está basada en los electrodos de cobre. La disolución A de sulfato de cobre(II), es 1M, mientras que la de B 0,017M. La energía libre desarrollada por dicha pila será aproximadamente en kilojulios:
a) 20 b) 16
c) 10 d) 18
DATOS: 1F=96.487C.mol-1
132*.El permanganato potásico oxida al oxalato sódico hasta dióxido de carbono, en medio ácido. Ajusta la reacción. De esta reacción, dirás que:
a) El oxalato sódico es el agente reductor que pierde 2 electrones por
mol
b) Se transfieren 5 electrones por mol de permanganato
c)El volumen de CO2 obtenido con 20mL de permanganato 0,1M
a 0,9 atm y 20ºC es de2L
d) Si la diferencia de potencial obtenida es de 2V, la energía libre por
mol proporcionada es de 193kJ
DATOS: 1F=96.487C.mol-1
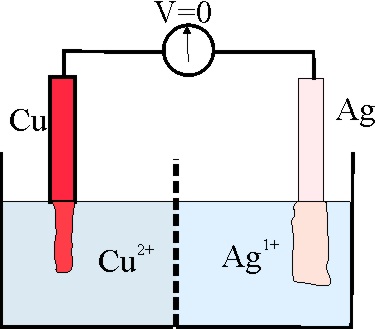
133. Cuando una pila electroquímica se agota, la diferencia de potencial generada es 0, y en este momento se produce un equilibrio entre reaccionantes y productos, por lo tanto el valor de Q, en la ecuación de Nernst, coincide con la constante de equilibrio, de esta forma dirás que en la pila dada en la figura, y con los datos de la tabla anterior (test 127), que dicha constante vale aproximadamente:
a) 2.1010 b) 4.1015 c) 3.1020 d) 5.1030
134*. El oxígeno es capaz de oxidar en condiciones normales y medio ácido al yodo a yodato, reduciéndose a O2-. Si en este proceso la ddp generada en estas condiciones es de 0,03V. dirás que :
a) El ajuste redox del proceso implica 10 moles de electrones por mol
de yodo
b)El equilibrio se producirá a una concentración de H+ de 10molL-1
c) La constante de equilibrio vale aproximadamente 1,3.1010
d)El equilibrio se desplazaría hacia la derecha si en la cubeta echaras
unos cristales de yodo
135*.Aunque Wohler surge en los libros de química como el primer científico que realizó una síntesis orgánica; la de la urea, en 1828, sin embargo su efigie aparece en una medalla conmemorativa junta la de Napoleón III por la primera obtención del aluminio, que realizó reduciendo con potasio metálico el cloruro de aluminio que había conseguido Oersted, procedimiento bastante caro, que motivó que se le denominara a dicho metal plata de la Tierra. De este sistema redox y con los datos de la tabla de potenciales normales de reducción podrás asegurar que:
a) El ánodo del proceso será el sistema Al3+ + 3e-=Al
b)La diferencia de potencial de la pila así formada será 1,26V
c) Cuando la diferencia de potencial disminuya en 0,5V, la relación entre
las concentraciones de los iones será aproximadamente 1025
d) La constante de equilibrio de dicho sistema valdrá 1064
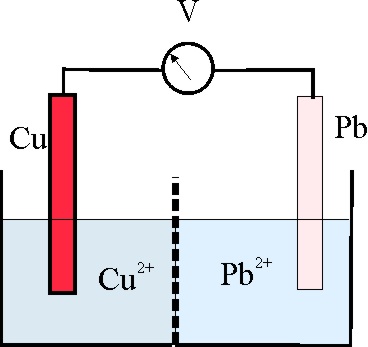
136*. En el montaje dado, y con los datos de la tabla de potenciales, podrás asegurar que:
a)La mayor energía libre liberada por la pila vale -90 kJ,
b)La relación de las concentraciones iónicas cuando la diferencia de potencial
generada sea 0,2V, es aproximadamente1,4.109
c) La constante de equilibrio vale 2.1010
d)El equilibrio se desplaza hacia la izquierda si se disuelven unos cristalitos
de sulfato de cobre(II)
DATOS: 1F=96.487C.mol-1

137*. En el montaje dado, se observa una pila entre una lámina de cobre sumergida en una disolución de sulfato de cobre(II), y otra de estaño inmersa en otra de cloruro de estaño. Teniendo en cuenta los potenciales normales de la tabla, podrás asegurar que:
a) La notación esquemática de la pila será en condiciones normales:
![]()
b)La relación de las concentraciones de los iones en estas circunstancias
será aproximadamente 2,7.105
c)La relación anterior, cuando el voltímetro marque cero, será el doble
d)La constante de equilibrio del sistema será 1,87.1016
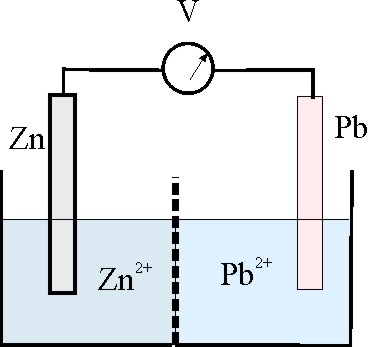
138. En el montaje dado, y con los datos de la tabla de potenciales, podrás asegurar que:
a) El cátodo de la pila será la hemicelda de la izquierda
b) La mayor energía libre liberada por la pila vale,-121kJ
c) La relación de las concentraciones
iónicas cuando la diferencia de potencial generada sea 0,2V, es de 3,77.1014
d) La constante de equilibrio vale aproximadamente 2.1021
DATOS: 1F=96.487C.mol-1
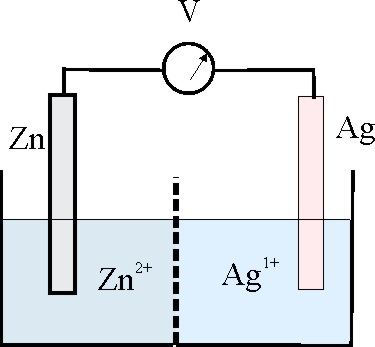
138. En el montaje dado, y con los datos de la tabla de potenciales, podrás asegurar que:
a) El cátodo de la pila será la hemicelda de la izquierda
b) La mayor energía libre liberada por la pila vale,-121kJ
c) La relación de las concentraciones
iónicas cuando la diferencia de potencial generada sea 0,2V, es de 3,77.1014
d) La constante de equilibrio vale aproximadamente 2.1021
DATOS: 1F=96.487C.mol-1

140*. En el montaje dado, se observa una pila entre una lámina de Zn sumergida en una disolución de sulfato de cinc, y otra de estaño inmersa en otra de cloruro de estaño. Teniendo en cuenta los potenciales normales de la tabla, podrás asegurar que:
a) La notación esquemática de la pila será:
![]()
b)La relación de las concentraciones de los iones en estas circunstancias
será aproximadamente 0,1
c)La relación anterior, cuando el voltímetro marque cero, será 1
d)La constante de equilibrio del sistema será 1021