
Foto 1
ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
81*.El cinc se obtiene fundamentalmente de su sulfuro, la blenda, llamada así porque los mineros que buscaban sulfuro de plomo, lo extraían de cinc, de igual apariencia, sintiéndose engañados por ello, ya que blenden en alemán significa engañar. Para ello, después de beneficiarlo, separando la ganga, hay que tostarlo con oxígeno, produciendo el óxido y dióxido de azufre, y finalmente reducir el óxido de cinc, con carbón, obteniendo el metal y monóxido de carbono. De estos procesos dirás que:
a) En la tostación en Zn no se oxida ni se reduce
b) Los oxidantes son el oxígeno y el óxido de cinc
c) El azufre va a perder 4 electrones
en la tostación
d) Se necesitan 3 moles de oxígeno
en la tostación para obtener 2 moles de átomos de cinc
82*.El primer metal que conoció el hombre primitivo fue el oro, que relacionó con el sol por su brillo y color, de ahí su nombre. Posteriormente encontró la plata, nombre inicialmente extraño a las caracterís-ticas del metal (fue argenta platta) y el cobre, muy común en Chipre(Cyprum), de donde toma el nombre. Sólo estos tres aparecían nativos y su beneficio no requería tratamiento alguno. Ello era debido a que:
a) No se combinaban con el oxígeno del aire
b) Tenían potenciales de reducción superiores a los del par O2/O2-
c) Tenían potenciales de reducción mayores de 0
d) No se disolvían en el agua
83*.Por poco que hayas estado en un laboratorio de química, habrás observado que el ácido nítrico se guarda en frascos opacos y coloreados. Esto es debido a que por acción de la luz se descompone, dando lugar al dióxido de nitrógeno y oxígeno. En este proceso:
a) El ácido nítrico se reduce ganando
cada nitrógeno, un electrón
b) El oxígeno del agua, será el
elemento que pierda los electrones
c) El ajuste redox implica que 4 moles de ácido nítrico produzcan un mol
de oxígeno
d) En la reacción final aparecería
una sola especie química en el primer miembro

Foto 1
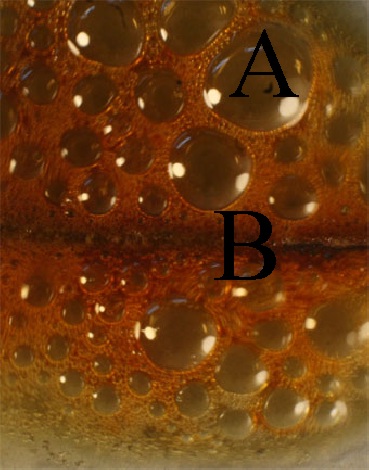
Foto 2
84*. Las fotos dadas correspon-den a la reacción entre el ácido nítrico concentrado y el hierro de un clavo (foto 1). A lo largo de la reacción y como se puede apreciar prácticamente el clavo desaparece al atacado por el ácido nítrico (foto 2). De la reacción redox ocurrida podrás asegurar que:
a)El agente reductor es el Fe3+
b)El oxidante gana un mol de electrones por cada mol
c)A son las burbujas de la for-ma oxidada
d) B será lo que queda del clavo en forma de nitrito de hierro(III)
85*.Aunque el ácido nítrico es un ácido fuerte, no se debe emplear en las reacciones de desplazamiento con metales, pues debido a su característica inestabilidad, se reduce fácilmente llegando a producir si está diluido, óxido de nitrógeno (I) y hasta nitrógeno libre. Así, lo hace si haces reaccionar dicho ácido, en una disolución bastante diluida, con un metal reductor como el cinc. En esta reacción:
a) Para producir un mol de nitrógeno, el ácido nítrico necesitaría de
10 electrones
b) El ajuste elemental implicaría
que 5 moles de átomos de cinc reaccionarían con 2 de ácido nítrico
c) Si dispones de 50cm3
de una disolución de ácido nítrico al 2% con densidad aproximada de 1g/cm3
obtendrías 30 cm3 de N2 en condiciones normales
d) Se formaría también nitrato
de cinc
Masa molar del ácido nítrico 63g.mol-1. Volumen molar de un
gas en C.N. 22,4L.mol-1

Foto 1

Foto 2
86. En las fotos observas la reacción entre un trozo de cinc y ácido nítrico 1,5M (foto 1)y como se produce la formación de nitrógeno gas (burbujas) y nitrato de cinc, aparte del residuo de cinc sin reaccionar ( foto 2). De todo el proceso dirás que:
a)Sólo el 17% del ácido nítrico actúa como oxidante
b)El cinc actúa como reductor, oxidándose a Zn3+
c)En la reacción se transfieren tantos
moles de electrones como moles de ácido nítrico se emplearon
d)El nitrato de cinc se combinará con el residuo de cinc
87*. Sin embargo
si el ácido nítrico está menos diluido, el proceso redox es diferente, dado
que se forma óxido de nitrógeno (I), gas incoloro. En este caso:
a) Solo el 20% del nítrico empleado actúa como
reductor
b) El ácido nítrico gana 8 moles de electrones
por mol empleado como oxidante
c) Se formarán 5 moles de agua
d) Se formará también nitrato de cinc
88*. El hematites es un óxido férrico que recibe el nombre por su color sanguíneo. Suele emplearse como mena del hierro en un alto horno, reduciéndose con monóxido de carbono, para producir hierro y el dióxido de carbono correspondiente. De estos procesos dirás que:
a) El mecanismo redox implica la
transferencia de 6 electrones
b) El carbono del CO aumenta su
número de oxidación
c) El hierro que casi siempre es
reductor actúa aqui como oxidante
d) Una tonelada de hematites supuesto
un rendimiento del 50%,necesitaría casi 10 metros cúbicos de monóxido de carbono
a 1 atmósfera y 1000EC
Masa molar del óxido férrico 159,8 g.mol-1
R=0,082 atm.L.K-1.mol-1
89*. El hierro dulce no se denomina así por su sabor, sino por una estructura parecida al azúcar, y se obtiene a través de una reacción en la cual la fundición (mezcla de hierro y carbón), en un horno de reverbero, funde y su carbono reacciona totalmente con más óxido férrico para producir hierro y monóxido de carbono. De este proceso dirás que:
a) Se transfieren 6 electrones por mol de óxido férrico
b) El carbono es el reductor
c) 3 moles de átomos de carbono reaccionan con dos de óxido férrico
d) En condiciones normales, un mol producirá 321 litros de gas
Volumen molar 22,4L.mol-1
90*. El agua oxigenada descubierta por Thenard en 1818 se podría emplear como reductor y como oxidante. De ahí su uso como blanqueante y antiséptico. Si en medio ácido se usa como reductor frente a un oxidante tan característico como el dicromato. De este proceso ajustado dirás que:
a) En el mecanismo redox se transfieren 6 electrones
b) Un mol de dicromato deberá producir casi 67 litros de oxígeno en condiciones
normales
c) En medio sulfúrico serían necesarios 7 moles de éste por mol de dicromato
d) El ajuste implicaría 7 moles de agua
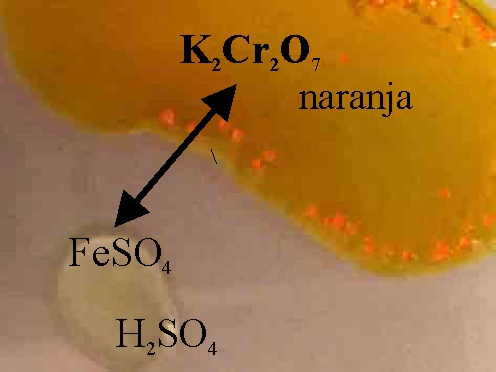
Foto 1

Foto 2
91*. Las fotografías dadas corresponden a la reacción entre el dicromato potásico y el sulfato ferroso en medio ácido (foto 1), para producir lo reseñado en la foto 2, de ellas podrás deducir que:
a) El oxidante tomará 6 electrones para reducirse
b) En el proceso se necesitan 7 moles de agua por mol de dicromato
c)El reductor será el sulfato férrico
d)En el proceso se necesitan 6 moles de ácido sulfúrico por mol de dicromato
92*.El dicromato potásico es una sustancia de color anaranjado mientras que el cromato es amarillo, y sólo actúa como oxidante en medio fuertemente ácido, reduciéndose a sal de cromo 3+, de color verdoso, de forma muy rápida, lo cual muchas veces resulta un inconveniente. Si al tratar de valorar una disolución de agua oxigenada,1 ml.de ésta consume 20 de disolución 0,1000 N de dicromato potásico, y sabiendo que la densidad del agua oxigenada es de 1,0 g/cm3.
a) 1 mol de dicromato oxida a 3 de peróxido de hidrógeno
b) Si el ajuste se realiza en medio sulfúrico se necesitarán 4 moles del
mismo
c) La concentración del agua oxigenada
deberá ser 1N
d) La riqueza del agua oxigenada deberá ser aproximadamente del 3%

Foto 1

Foto 2
93*. Una reacción característica del dicromato potásico es con una sal como el oxalato sódico (foto1). Los productos de la reacción son los que aparecen en la foto 2. De la misma podrás decir que:
a)El reductor perderá 6 electrones para oxidarse
b) En el proceso se necesitan 7 moles de agua por mol de dicromato
c)El oxidante será el dicromato potásico
d)En el proceso se necesitan 6 moles de ácido sulfúrico por mol de dicromato

94*. Aunque no lo creas, la reacción de desplazamiento entre el ácido clorhídrico y el cinc, para producir hidrógeno(gas), y cloruro de cinc, véanse las burbujas en la foto, es una reacción redox en la que:
a)El ácido clorhídrico actúa como oxidante
b)El H+, es capaz de tomar electrones del Zn
c)El Zn2+ toma electrones del Cl-
d) El hidrógeno gas es la forma oxidada
| V |
|
| F2 +2e→2F- |
2,87
|
| PbO2+2e→Pb2+ |
1,68
|
| MnO4-+5e→Mn2+ |
1,52
|
| Cl2+2e→2Cl-
|
1,36
|
| Cr2O7
2+6e→2Cr3+ |
1,33
|
| O2+4e→2H2O
|
1,23
|
| Br2+2e→2Br-
|
1,06
|
| NO3-+3e→NO
|
0,96
|
| Ag+
+e →Ag |
0,80
|
| I2+2e →2I-
|
0,53
|
| Cu2++2e →Cu |
0,34
|
| 2H+ +2e →H2 |
0,00
|
| Pb2++2e
→Pb |
-0,13
|
| Sn2++2e
→Sn |
-0,14
|
| Ni2++2e
→Ni |
-0,24
|
| PbSO4+2e→Pb Fe2++2e
→Fe |
-0,36
-0,44 |
| Zn2++2e
→Zn |
-0,76
|
| Mn2++2e
→Mn |
-1,19
|
| Al3++3e
→Al |
-1,66
|
| Mg2++2e→Mg
|
-2,37
|
| Na++e→Na
|
-2,71
|
| K++e→K
|
-2,92
|
| Li++e→Li
|
-3,05
|
95*. Aunque Wohler surge en los libros de química como el primer científico que realizó una síntesis orgánica; la de la urea en 1828, sin embargo su efigie aparece en una medalla conmemorativa junto la de Napoleón III por la primera obtención del aluminio, que realizó reduciendo con potasio metálico el cloruro de aluminio que había conseguido Oersted. Del proceso redox de obtención, y dada la tabla de potenciales normales, dirás que:
a) El Al 3+, gana 3 electrones al potasio
b) El poder reductor del potasio
supera en 1,3V al del aluminio
c) El ion cloruro no afecta al proceso redox
d) La pila formada generaría 1 voltio de diferencia de potencial
96*. El yodo fue el segundo halógeno descubierto, después del cloro, hecho realizado por Courtois en las salinas de su padre, en 1811. Sin embargo su nombre fue dado por Gay Lussac, 3 años más tarde debido a sus vapores violetas, producidos al sublimarse. Como es lógico es poco soluble en agua, a la que amarillea, aunque colorea fuertemente de azul la disolución de almidón, por formar un complejo. Este hecho, junto con el tener un potencial normal intermedio, hace que sea empleado como agente valorador redox en las yodometrías, tanto para oxidantes como para reductores. Si tienes en cuenta la tabla de potenciales, y con 2 ml.de disolución acuosa de ácido sulfuroso consigues decolorar 20 ml. de disolución 0,1N de yodo, con todo ello podrás asegurar que en este proceso
a) El yodo actúa como oxidante
b) La normalidad del ácido sulfuroso es 2
c) En condiciones normales un litro de disolución de ácido sulfuroso deberá
contener 11,2 litros de dióxido de azufre
d) La diferencia de potencial
entre ambos sistemas será de 0,37V
E0(H2SO4/H2SO3)=0,172V.
Volumen molar de un gas=22,4L.mol-1
97*.El sodio es un metal muy reductor y debido a esto debe guardarse muy lejos del oxígeno del aire. No debe extrañarte por lo tanto verlo en el laboratorio, ya en frascos a vacío o sumergido en petróleo. Reacciona violentamente con el agua, y más de un científico perdió la vista al proyectarse sobre sus ojos el hidróxido sódico formado que acompaña al hidrógeno. De este proceso dirás que:
a) El hidrógeno se reduce actuando
como oxidante, transfiriéndose 2 electrones, por mol de agua
b) 2 moles de átomos de sodio producirán un mol
de hidrógeno
c) 2,3 gramos de sodio producirán
1,1 litros de hidrógeno en condiciones normales
d) Si disuelves 2,3g de sodio en 1 litro de agua, el pH de la disolución resultante
sería aproximadamente de 13
MASAS ATÓMICAS: Na,23/ O,16/H,1
98*.En plena Edad Media, un descubrimiento que cambiaría el curso de la Historia, modificando el "arte de la guerra", invade Europa. Era un polvillo negro, procedente de Oriente, que tenía un olor extraño. Por su apariencia se le denominó: pólvora. La pólvora negra era en realidad una mezcla de productos naturales: salitre o nitro (nitrato potásico), carbón y azufre, y su explosión, una reacción redox violenta, explicada por Bunsen y Schischkov, profesor de la Escuela de Artillería de San Petersburgo, en 1857.En ella el nitrato potásico reacciona carbono y azufre, los tres sólidos para producir nitrógeno, dióxido de carbono y dióxido de azufre; los 3 gases. Por ello la reacción
a) Con los productos dados la reacción
deberá ajustarse en medio básico
b) 4 moles de nitrato reaccionan con 5 moles de
átomos de carbono e igual cantidad de azufre
c) En el proceso redox se transfieren
20 electrones
d) La reacción es explosiva porque
rápidamente a partir de reaccionantes sólidos se obtienen gran cantidad
de gases
99*. Muchas veces cuando tienes objetos de plata adornando un aparador o consola observas en ellos manchas oscuras que suelen aumentar debido a la polución del aire. Generalmente de aluminio que llenas con una disolución diluida de hidróxido sódico (sosa).De esta manera se formará una pila electroquímica en la que el ion plata se va a reducir a plata metálica quedando el objeto completamente limpio. Si sabes que la reacción, en medio básico da lugar a la formación de aluminato sódico NaAlO2 asegurarás que:
a) El aluminio actúa como reductor
b) El sulfuro de plata es el oxidante
c) Se transfieren 6 electrones
por mol de aluminio
d) La reacción necesita para su
ajuste de 2 moles de sosa por 3 de sulfuro de plata
Masas Atómicas: Al,27/Na,23/O,16/H,1/Ag,107
100*. Si una corriente de cloro gas, pasa a través de una disolución alcalina, puede ocurrir que simultáneamente se oxide y se reduzca. Este proceso bastante generalizado en los oxiácidos del cloro, se denomina dismutación. Si sabes que en medio alcalino, se produce hipoclorito y cloruro podrás asegurar que
a) Si el medio fuera una disolución
de hidróxido sódico se necesitarían 2 moles de éste por mol de cloro
b) Los electrones que pierde el
cloro para pasar a hipoclorito los gana el mismo cloro para producir cloruro
sódico
c) Se transfiere un mol de electrones
por mol de cloro
d) El cloro actúa como oxidante
y como reductor