ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
Equilibrio Ácido-base 7
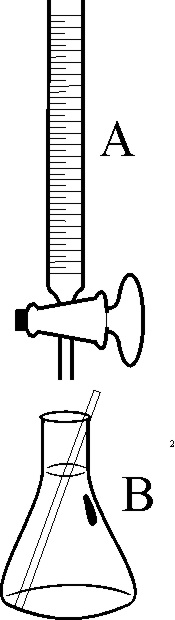
121*.La primea bureta se denominó
berthollímetro, no porque la hubiera creado Berthollet (ya que fue inventada
por otro francés, Descroizilles), sino en su honor. Se emplea para hallar la concentración de un ácido o de una
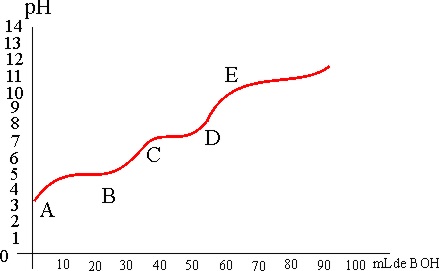
base, esto es valorarla, en función de su neutralización. Si en el dibujo
de la figura 1, se dispone en ella una base BOH de concentración conocida
en A, y en el erlemeyer inferior B, un volumen determinado de ácido AH, de
concentración desconocida, se puede valorar o titular (cuando se valora se
pone el título de su concentración). La mejor manera
para no equivocarse es ir midiendo el pH de la disolución del ácido,
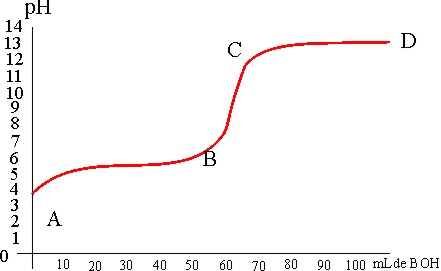
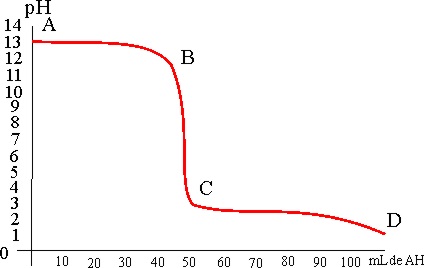
mientras se va neutralizando (fig.2), ya que en el punto de equivalencia,
cuando se ha neutralizado todo el ácido, se produce un salto en el pH (tramo
BC), que se puede visualizar por el cambio de color de un indicador químico
(viraje). Esta gráfica se conoce como curva de valoración.

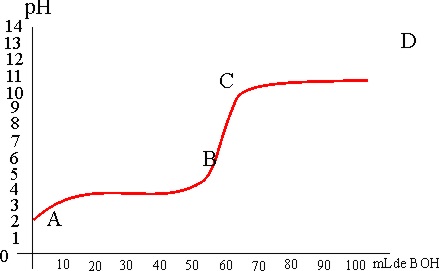
De la curva de valoración dada, podrás deducir que:
a) En el tramo AB ya se ha producido
la neutralización total
b) Cuando mayor sea el tramo BC, más diferencia habría entre él ácido y la
base
c) En el tramo CD ya se ha producido la neutralización
d) Cuanto mas alto sea el tramo CD, la base es más débil
122. La forma de la curva de valoración corresponde a la representación gráfica de la ecuación:
a)
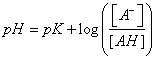 b)
b)
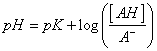
c)
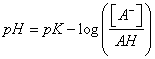 d)
d)
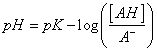
123. La ecuación de Henderson
–Hasselbalch
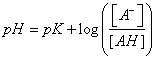 , fue creada por el bioquímico danés K.A.Hasselbalch a partir de una expresión
extraída de la ley de Acción de Masas de Guldberg y Waage, por el bioquímico
norteamericano Henderson en 1908,
, fue creada por el bioquímico danés K.A.Hasselbalch a partir de una expresión
extraída de la ley de Acción de Masas de Guldberg y Waage, por el bioquímico
norteamericano Henderson en 1908,
![]() , que también creó el término puffer
para algunas disoluciones que se originaban en estas neutralizaciones. Dicho
término, junto con el de tampón sugerido por Sörensen, maestro de Hasselbalch,
se aplica actualmente a las:
, que también creó el término puffer
para algunas disoluciones que se originaban en estas neutralizaciones. Dicho
término, junto con el de tampón sugerido por Sörensen, maestro de Hasselbalch,
se aplica actualmente a las:
a) Disoluciones amortiguadoras
b) Disoluciones tampones
c) Disoluciones de ácidos y bases fuertes d) Disoluciones de ácidos y bases débiles
124. La gráfica de la figura corresponde a la curva de valoración de:
a) Un ácido fuerte con una base fuerte
b) Un ácido fuerte con una base débil
c) Un ácido débil con una base fuerte
d) Un ácido débil con una base débil
125. Si en el esquema de la figura
1, dispones en B, una base fuerte y en A un ácido de concentración conocida,
la curva de valoración de más apropiada
de todas las dadas sería la:
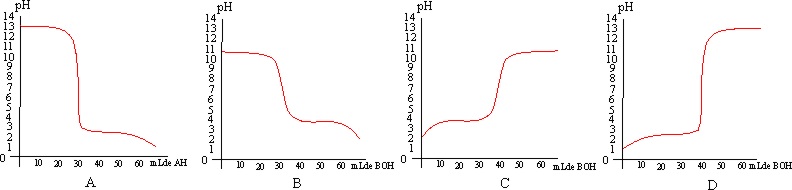




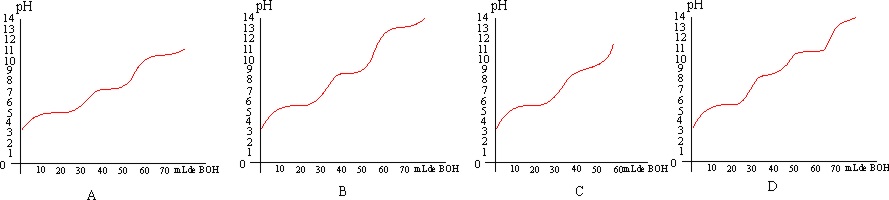
la a) A
b) B c) C d) D
135*. Una disolución amortiguadora, reguladora, tampón o buffer, es una disolución de un ácido o base débil en igual proporción que la propia sal del ácido o base fuerte., porque cuando se realiza la misma, dicha mezcla, aunque se le agregue un ácido o una base fuerte en pequeña cantidad tiende a tener un:
a) pH constante b)
pK constante c)
pH = pK d) equilibrio
136. El pH de nuestra sangre es 7,4. En una persona sana, la variación puede ser de 7,2 a 7,6, como máximo. Sin embargo a la sangre van muchos restos ácidos y bases, que lo modificarían mucho mas. Si varía hasta 4 décimas podríamos morirnos al producirse un shock (como ocurre por ejemplo en una persona diabética). Si disminuye por debajo de 7,4 se dice que el paciente presenta acidosis, y sube, alcalosis. Para evitarlo la sangre posee 3 amortiguadores: los pares carbónico/hidrógenocarbonato H2CO3/HCO3-; pK=6,1; dihidrógenofosfato/hidrógenofosfato H2PO4-/HPO42-, pK=7,2 y la hidrógenohemoglobina/oxihemoglobina pK 7,16. El más usado es el empleado por la propia respiración, con el par CO2/ HCO3-, así la proporción en que debe encontrarse la concentración de ambos para que el pH sea 7,4 deberá ser de aproximadamente :
a) 10 b) 1 c) 20 d) 100
137. Ocurre acidosis, si el pH sanguíneo baja de 7,4, cuando haces un gran esfuerzo físico, un partido o una carrera y necesitas una gran cantidad de oxígeno para aportar energía a los tejidos, si no llega éste, la glucosa energética lo toma transformándose en ácido láctico (agujetas). Si no tienes glucosa insuficiente (huelga de hambre, o diabetes), el organismo toma la energía a partir de las grasas almacenadas en tu organismo, formando productos ácidos que aumentan la acidosis. También ocurre acidosis con determinados medicamentos (aspirina), la ingestión de alcohol, las diarreas y naturalmente en enfermedades del riñón. Ocurre alcalosis, si el pH sube de 7,4, cuando tienes gran cantidad de vómitos, tomas diuréticos, o regaliz. Por eso usamos sistemas amortiguadores biológicos, uno de los cuales es el hidrógeno fosfato/ dihidrógeno fosfato, en el cual el primero actúa como base y el segundo como ácido. Si el pK del sistema es 7,2 y se dispone de hidrógenofostato 0,16M, la concentración de dihidrógenofosfato necesaria para que el pH sea 7,41 será:
a) 0,16M b) 0,2M
c) 0,25 d) 0,1M
Si a 100ml del sistema anterior se le agregan 100ml de ácido clorhídrico estomacal 0,1M, el pH ahora del sistema será aproximadamente:
a) 7,2 b) 6,9 c) 7,1 d) 6,7
138. Si la solubilidad del CO2 en la sangre es de 0,031 mmoles/L mmHg, la concentración de CO2 y de hidrógeno carbonato para que el pH de la muestra sanguínea se conserve en 7,4, siendo el pK 6,1 y la presión normal del CO2 , 33mmHg, deberá ser respectivamente en mmolesL-1 , de:
a) 1 y 20 b)
20 y 1 c) 10 y 10 d) 10 y 20
139. Si a 10mL de una disolución formada por una mezcla de ácido acético 0,1M y acetato sódico 0,1M, se le agregan 3mL de ácido clorhídrico 0,025M, el pH de la disolución formada será:
a) 5,00 b) 4,55 c) 4,86 d) 4,68
pK=4,75
140. Se pretende preparar 1L de una disolución reguladora de pH 8,5, para ello eliges un ácido cuyo pK, difiera como máximo en una unidad respecto al pedido; en este caso el cianhídrico (pK=9,3) para lo cual lo mezclas con una disolución de cianuro potásico 0,01M.Los gramos de ácido que deberán añadirse para obtener dicha disolución serán:
a) 1,74 b) 2,00
c) 1,87 d) 1,55
Si a la disolución dada se le agregan 0,005 moles de ácido perclórico el pH de la disolución será:
a) 8, 21 b)
8,17 c) 8,71 d) 8,5
Mientras que si se le agregaran 0,005 moles de hidróxido potásico, el pH sería:
a) 8, 21 b)
8,17 c) 8,71 d) 8,5
Datos Masa molar del HCN= 27g.mol-1.
126. La gráfica de la figura corresponde a la curva de valoración de:
a) Un ácido fuerte con una base fuerte
b) Un ácido fuerte con una base débil
c) Un ácido débil con una base fuerte
d) Un ácido débil con una base débil
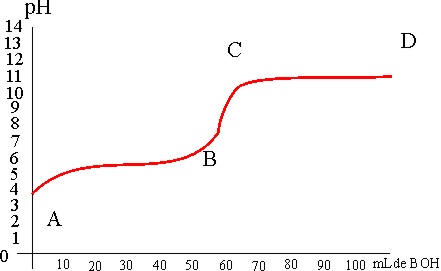
127. La gráfica de la figura corresponde a la curva de valoración de:
a) Una base fuerte con un ácido fuerte
b) Una base débil con un ácido fuerte
c) Un ácido débil con una base fuerte
d) Un ácido fuerte con una base débil
128. En la curva de valoración de un ácido, cuando mas pequeño sea el tramo BC, querrá decir que, la reacción de neutralización se producirá entre:
a) Un ácido fuerte con una base fuerte
b) Un ácido fuerte con una base débil
c) Un ácido débil con una base fuerte
d) Un ácido débil con una base débil
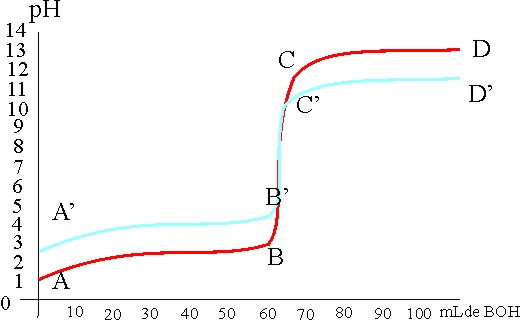
129. La gráfica de la figura corresponde dos curvas de valoración ABCD y A’B’C’D’, esta última difiere de la primera en que se valora :
a) Un ácido fuerte más concentrado con una base fuerte más concentrada
b) Un ácido fuerte más diluido con una base fuerte más concentrada
c) Un ácido fuerte más concentrado con una base fuerte más diluida
d) Un ácido fuerte más diluido con una base fuerte menos concentrada
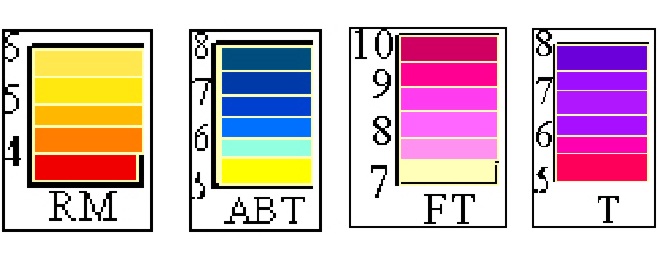
130.Las gráficas de valoración son muy importantes para saber qué indicador químico deberá usarse para acertar el punto de equivalencia, ya que el ácido deberá cambiar de color según el indicador en el salto del pH, por eso dados los cambios de color de los indicadores fenolftaleina FT, rojo de metilo RM tornasol T, y azul de bromotimol ABT, dirás que para la curva de valoración dada el indicador mas apropiado para usar será:
a) T b) FT c) RM d) ABT
131. Dados los cambios de color de los indicadores químicos:fenolftaleina FT, rojo de metilo RM tornasol T, y azul de bromotimol ABT, con el pH, el más apropiado a emplear para echar en el ácido a valorar, cuya curva de valoración te dan será:
a) T b) F c) RM d) ABT
132. Si en la gráfica dada en el test anterior, echaras sobre el ácido fuerte situado en B de la figura 2, rojo de metilo, tendrías un error debido a que:
a) Cambiaría de color antes
b) Viraría su color mas tarde
c) Daría una concentración por defecto
d) Darías una concentración por exceso
133. Los ácidos poliprótidos se disocian sucesivamente, y por lo tanto tienen varios puntos de equivalencia, según se vayan neutralizando los iones H+, por lo tanto la gráfica de la figura corresponde a la neutralización de un ácido con:
a) un H+
b) 2H+
c) 3H+
d) 4H+