ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
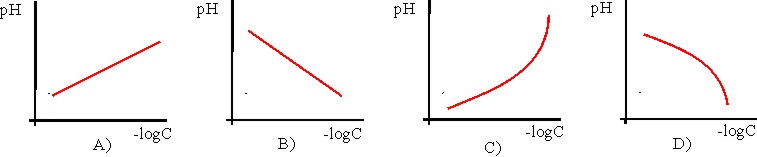
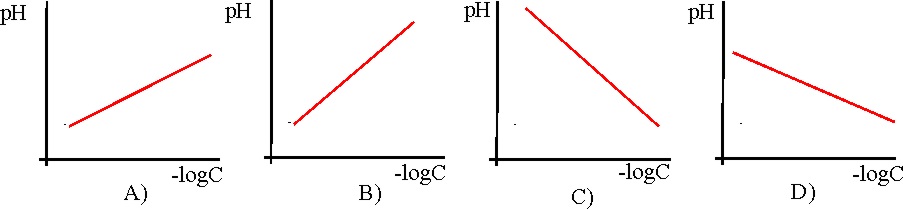
21. Si se dispone una disolución
acuosa de un ácido débil AH, y se modifica la concentración C de la misma,
la gráfica pH, frente a –logC, que mejor representan dicha variación es la:

a) A
b) B
c) C
d) D
22*. Cuando se representa la variación de pH frente al –log de la concentración de varios ácidos débiles, se observa que las gráficas:
a) Nunca cortan al eje Y
b) Nunca pasan por el origen
c) Siempre tienen la misma pendiente
d) Siempre son rectas descendentes
23. Dadas las gráficas pH frente
a –logC, para un mismo ácido débil cuya concentración va variando, de todas
las dadas, la correcta será la:
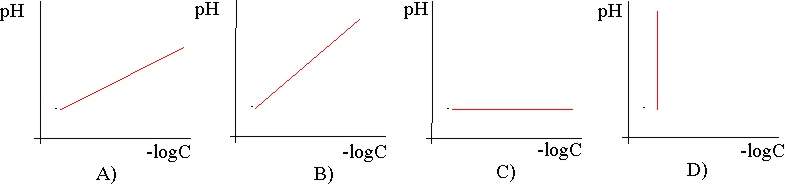
a) A b) B c)
C d) D
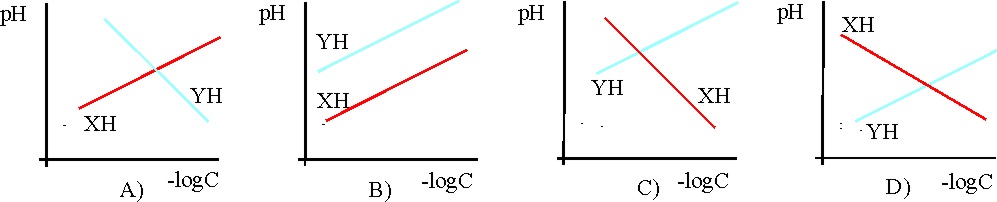
a) La A b) La B c) La C d) La D
La única posible de las dadas es la:
a) A b) B c) C d) D
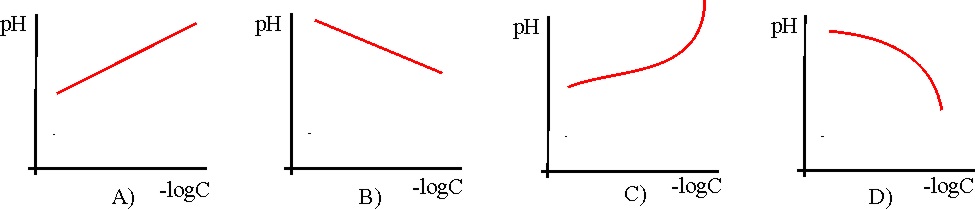
26. Dada las gráficas de variación del pH para un ácido fuerte, en función del -log de su concentración:
La única posible de las dadas es la:
a) A b) B c) C d) D
27. Dada las gráficas de variación
del pH para una base fuerte, en función del -log de su concentración:

La única posible de las dadas es la:
a) A b) B c) C d) D
Kw=10-14
28. El primer nombre del ácido clorhídrico, aparece en los escritos de Basilio Valentino, en el siglo XV, pues haciendo reaccionar "sal marina con vitriolo marcial, se producía un líquido que quemaba, que llama aqua cáustica y un espíritu que se desprendía, que nombra spiritus salis acidus".Aquí lo tenemos; espíritu por que es un gas (todavía no se conocía este término). Acidus porque picaba, y salis, porque se extrajo de la sal. Es un ácido fuerte. Si se dispone de una disolución acuosa cuya concentración es de 0,01M, dirás que:
a) La concentración de OH- es mayor que la de H3O+
b) Nunca puede haber pOH
c) El pH es 2
d) El pOH es menor que 7
Kw=10-14.
29. El símbolo K del potasio se debe al profesor alemán Gilbert, que a principios del XIX, propuso para él, el nombre de kalium. Por eso el hidróxido potásico o potasa, tiene por fórmula actual KOH. Es una base fuerte. Si se dispone de una disolución 0,001M de la misma dirás que:
a) La concentración de OH- es mayor que la de H3O+
b) Nunca puede haber pH
c) El pH es 3
d) El pOH es mayor que 7
Kw=10-14.
30.La urea, (NH2)2CO, diamida del ácido carbónico, fue llamada por Rouelle, profesor de Lavoisier, que la aisló en 1773, con el poético nombre de extracto jabonoso de la orina, por hacerla responsable de la espuma que se produce en aquella. También es motivo de la reacción básica normal en la orina que generalmente presenta una concentración de iones hidrógeno 2.10‑9 moles/litros, de lo que deducirás que su pH será:
a) 8,4 b) 8,5 c) 8,6 d) 8,7
31.En todas las cocinas existe una botella de vinagre, nombre que procede del francés vin agrée, vino agrio producido en la fermentación de las manzanas. El ácido más abundante en el vinagre es el acético, cuya constante Ka=1,8.10‑5. Si el pH de una disolución de vinagre es 2,8 y su densidad es aproximadamente 1 g/cm3, dirás que su porcentaje en ácido acético es aproximadamente del:
a) 9% b) 1% c) 8% d) 0,8%
MASAS ATÓMICAS: C=12, H=1; O=16
32.Los mamíferos eliminan el nitrógeno en forma de urea, pero los peces, lo hacen como amoniaco, por lo tanto en los acuarios se debe controlar muy bien el pH, para evitar que se mueran los peces. Si las especies contenidas, eliminan amoniaco proporcionando una concentración 0,023 M. Dirás que el pH de la disolución del acuario será :
a) 8,1 b) 10,8 c) 11,2 d) 11,8
Kb=1,8.10‑5
33.El zumo de limón es una de las bebidas más refrescantes en épocas calurosas. En él existe aparte de ácido cítrico, el responsable del sabor picante, aluminio, litio, boro, cobalto, cinc, estroncio, bario, níquel, cromo y hasta circonio, vanadio y molibdeno. El ácido más abundante, el cítrico 3‑hidroxi‑3‑carboxipentanodioico, es tricarboxílico con formula empírica C6H7O7, y su primera disociación tiene una constante de equilibrio Ka1=8,2.10‑4. Si todo el ácido que existe en un vaso de 100ml.de zumo de limón, es el cítrico y su pH es 2,1, dirás que el % que contiene de dicho ácido en el zumo es del:
a) 13% b) 1,3% c) 0,13% d) 0,013%
DATOS: (densidad del zumo 1,1
g/cm3). MASAS
ATÓMICAS: C=12, H=1; O=16
34.El benceno es punto de partida de multitud de compuestos. Su sulfonación, produjo los primeros detergentes, dio lugar a las sulfamidas, y fue punto de partida de la elaboración del primer edulcorante artificial, la sacarina C7H5SNO3, que es una amida del ácido benzoico sulfonado. Este compuesto se disocia dando un protón (el unido al nitrógeno), con una constante Ka=2,5.10‑12. El pH aproximado de una solución edulcorante preparada con 10 gramos de sacarina en cuarto litro de agua será de:
a) 3,1
b) 4,1 c) 5,1 d) 6,1
MASAS ATÓMICAS: C,12/S,32/N,14/O,16/H,1.
35. La etanolamina, se encuentra entre los productos de degradación de las cefalinas, que tienen un papel esencial en la coagulación de la sangre. Su Kb=3,2.10‑5. Según ese dato el pH de una solución 0,5M de esa sustancia será :
a) 10,6 b) 9,6 c) 11,6 d) 12,6
36.Uno de los venenos de acción más rápida sobre el organismo, es la nicotina C10H14N2O, que aunque no lo creas también se usó como insecticida. Si la Kb, responsable de su basicidad vale 1.10‑6, el pH de una solución que contenga 10 g.de nicotina por litro, será aproximadamente de:
a) 10,4
b) 9,4 c) 11,4 d) 12,4
MASAS ATÓMICAS: C,12//N,14/O,16/H,1.
37.El ácido barbitúrico principal agente de suicidios de los americanos de los años sesenta, es un ácido débil cuyo pK=4,01, de fórmula empírica C4H4O3N2. Si se dispone de una disolución 0,1M, dirás que su grado de disociación será aproximadamente :
a) 0,05 b) 0,04 c) 0,03 d) 0,02
mientras que el pH de la misma será:
a) 1
b) 2 c) 3 d) 4
MASAS ATÓMICAS: C,12//N,14/O,16/H,1.
38.Las dietas con bajos contenidos en calorías, eluden los hidratos de carbono como edulcorantes, siendo sustituidos no pocas veces por ciclamatos (sobre todo en bebidas refrescantes),que pueden producir a la larga cáncer de vejiga. El padre de aquellos, es la ciclohexilamina, C6H11-NH2, base débil con característico olor a pescado, que produce en la piel la misma sensación que la ortiga. Si su Kb=4.10‑4, dirás que el pH de una solución acuosa del ciclohexilamina que contiene 15g. por litro, será:
a) 10,9
b) 11,9 c) 12,9 d) 13,9
MASAS ATOMICAS:C=12/H=1/N=14.SOL=11,9
39. Tostando un kilogramo de pirita FeS2, del 92% de riqueza y oxidando el gas formado hasta transformarlo después en ácido sulfúrico con un rendimiento del 50%, y que disolvemos en 77 litros de agua. El pH de esta disolución será:
a) 1
b) 1,2 c) 0,9 d) 1,5
MASAS ATOMICAS:S=32/Fe=56/O=16/H=1
Considérese sólo la primera disociación
40.En una carta escrita el 25 de abril de 1763,el reverendo Stone, comunicaba al presidente de la Sociendad Real de Londres, que "existía un árbol inglés cuya corteza era un poderoso astringente muy eficaz para curar enfermedades agudas y recurrentes". Este árbol era el sauce. En 1828 Buchner aislaba de los extractos de corteza, un ácido que Piria, en 1838 bautiza como salicílico, y que 3 años antes Lowig llamó Spirsaure (ácido del sauce, en alemán). Inicialmente muy caros, los salicilatos se pusieron de moda en París en 1877, para curar la gota y la artritis. Los problemas estomacales que producían fueron aminorados acetilando el grupo hidroxilo del ortohidroxibenzoioco, C7H6O3. Surge así la aspirina, llamada así por Bayer, con la a de acetil y la spirina del spirsaure alemán.Su Ka=3,3.10‑4. Si su solubilidad es de 0,35 g.por 100 ml.de agua, el grado de disociación del ácido en una disolución saturada será aproximadamente:
a) 0,1 b) 0,01 c) 0,2 d) 0,02
mientras que el pH de dicha disolución será:
a) 2,2 b) 2,6 c)
2,8 d) 3