TEST DE EQUILIBRIO
QUÍMICO III
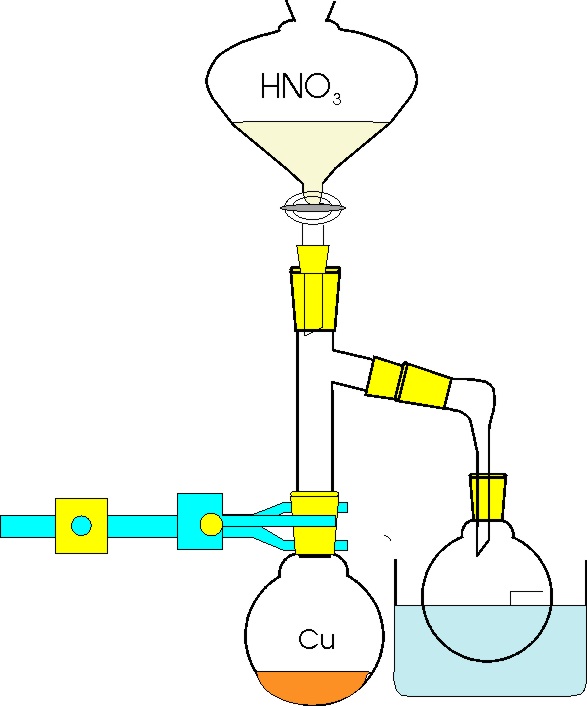
41. En un alto horno se producen
numerosos procesos químicos porque el carbón que alterna con el óxido férrico
se combina con el oxígeno insuflado por las toberas, produciéndose CO y CO2,
a través de procesos tales como: CO+1/2 O2 = CO2 (Kp1)
y C (grafito)+CO2 (g)=2CO (g) (Kp2). Con los datos dados,
dirás que Kp, para el proceso C(s)+ O2 (g) = CO2 (g),
será:
a)
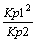 b)
b)
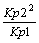 c)
c)
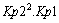 d)
d)
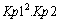
42*.Aunque se creyó durante mucho
tiempo que los gases nobles tenían valencia 0, en 1966, el inglés Bartlett,
demostró que los más voluminosos se combinaban con el flúor, encontrando el
difluoruro y el tetrafluoruro de xenón. Si a una determinada temperatura el
xenón se combina con el flúor gas, formándose tetrafluoruro de xenón gas,
de tal manera que partiendo de 0,4 moles del primero y el doble del segundo,
en un recipiente de 2 litros, se obtiene un 60% de tetrafluoruro dirás que
Kc vale:
a) 25 b) 58 c)
0,25 d) 0,58
Si
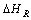 =-218 kJ/mol, dirás que:
=-218 kJ/mol, dirás que:
a)
La reacción será exotérmica
b)
La reacción será endotérmica
c)
Si se duplica la temperatura la constante de
equilibrio aumenta
d)
Si se enfría el sistema el equilibrio se desplaza
hacia la derecha
43*. Todos los años puedes leer
en la página de sucesos del periódico, el número de fallecimientos por ingerir
bebidas adulteradas con alcohol metílico en vez del vínico.Una simple copa
con 10 mL puede producir la ceguera por atacar el nervio óptico y después
la muerte. Aquél, que inicialmente se extrajo de la madera, de ahí su nombre
("madera que emborracha"), es mucho más barato, pues se puede obtener
por síntesis a partir de CO + 2H2, todos gases. Si para este proceso
la variación de energía libre es 24,7 kJ/mol, a 27ºC, podrías asegurar que:
a) La reacción se produce con un aumento de entropía
b) La reacción es siempre exotérmica
c) Se producirá mayor cantidad de metanol si aumenta la presión
d) Kp vale 5,2.10-5
DATOS: R=8,31 J.K-1.mol-1
44*. La primera sistemática periódica
fue realizada por Döbereiner y por ello es conocido. Lo que pocos saben es
que este científico obtuvo por primera vez el etanal o acetaldehido en 1821.Este
compuesto en estado puro se descompone al ser calentado. Así si introduces
en un recipiente de 5 litros, previamente evacuado, que se mantiene a 154,6ºC,
en un baño de aceite, una determinada cantidad de etanal siendo la presión
inicial de 363 tor se irá descomponiendo en metano y monóxido de carbono hasta
que la presión se estabiliza en 450 mm.de Hg, alcanzándose el equilibrio.
En esta situación dirás que:
a) Queda un 76% de etanal sin reaccionar
b) Si el recipiente aumentara de volumen hasta 10 litros, el grado de
disociación también aumentaría
c) Si aumentara la presión sobre el recipiente una vez alcanzado el equilibrio,
se produciría más metano.
d) Kp sería de 2,2
DATOS: R=0,082 atm.L K-1.mol-1
46*. El pentacloruro de fósforo
es uno de los compuestos en los cuales no se mantiene la teoría del octeto,
propuesta por Lewis para justificar el
enlace covalente, puesto que se rodea de 10 electrones y no de 8. Este compuesto
se descompone al calentarlo en tricloruro de fósforo y cloro. Así, si calientas
a volumen constante una cantidad determinada de pentacloruro de fósforo, hasta
los 250ºC, se alcanza el equilibrio cuando la relación entre las presiones
parciales del cloro y del compuesto inicial es de 1,3. Si sabes que a esa
temperatura Kp vale 1,8 y que el recipiente
tiene una capacidad de 5 litros, podrás asegurar que :
a) Kc vale 0,9
b) La presión total en el equilibrio es de 7,4 atmósferas
c) El equilibrio se desplaza hacia la derecha si se agrega cloro
d) El equilibrio se desplaza hacia la izquierda si se enfría
e) El grado de disociación es del 56%
47*.A temperatura ligeramente
superior a la ambiente, el yoduro de hidrógeno gas, tiene color violeta debido
a la disociación en hidrógeno y yodo (que es violeta, de ahí su nombre).El
color se hace más intenso al aumentar la temperatura a presión constante.
Con este dato dirás que:
a) La variación de entalpía en
la reacción será mayor que 0
b) Si K de equilibrio a 100ºC =0,00271,
el % del yoduro de hidrógeno disociado será del 9,4%
c) Si se mezcla con una cantidad
equimolar de nitrógeno gas a temperatura ambiente y luego se calienta hasta
100ºC, el grado de disociación aumenta
d) Si se mezcla con hidrógeno gas
el grado de disociación disminuye
48.El estaño se puede extraer
de la casiterita, dióxido de estaño sólido cuyo nombre procede del nombre
fenicio de las islas británicas:casitérides, puesto que en ellas se había
encontrado un metal como el del país de Casites, zona alta de Asia Menor.
En aquellas islas se denominaba stan,
del indoeuropeo stag, gotear. Por que este metal que tiene bajo punto de fusión,
y enseguida gotea al calentarse por eso se emplea para soldar (estañar). Se
obtiene por reducción de la casiterita con hidrógeno gas, dando lugar también
a agua gaseosa. Si a 500ºC en un recipiente de 10L, se obtienen 1 mol de hidrógeno
y otro del agua , dirás que Kc vale:
a) 1 b) 0,1 c)10 d) 0,01
49.La reducción de los óxidos
metálicos en un alto horno no se debe al carbón con que se mezclan sino al
monóxido de carbono que se forma a alta temperatura en la reacción entre el
carbono sólido y el dióxido de carbono
gas. Si a 1000ºC y 30 atm. el equilibrio del proceso es tal que el 17% de
los gases son dióxido de carbono. Si la presión
desciende a 20 atm, dirás que el % de dióxido de carbono es:
a) 12% b)
10% c) 12,6% d) 13%
50*. El amoniaco, cuyo nombre de origen egipcio, es uno de
los mas antiguos de la química, se llama actualmente en la nueva nomenclatura
sustitutiva, derivada de los sufijos orgánicos y de su nombre en el XVIII,
azano. A 400ºC y 1 atm de presión el amoniaco se encuentra disociado un 40%
en nitrógeno e hidrógeno gaseosos , si la reacción: NH3(g)
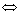 3/2 H2(g) + ½ N2(g).
Podrás decir
3/2 H2(g) + ½ N2(g).
Podrás decir
a) La presión parcial
del hidrógeno en el equilibrio0,43 atm
b) El volumen de la
mezcla si se parte de 170g de amoniaco es de 773L
c) Kp vale 0,25
d) Kc vale 12
DATOS: Masas atómicas: N=14; H=1 R=0,082 atm.L K-1.mol-1
51*. Si en un recipiente de 25L
se introducen 2 moles de hidrógeno , un mol de nitrógeno y 3,2 moles de amoniaco.
Cuando se alcanza el equilibrio a 400ºC, el número de moles de amoniaco se
ha reducido a 1,8. Para la reacción 3H2(g)+N2(g)
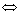 2NH3(g), dirás que
2NH3(g), dirás que
a) El número de moles de nitrógeno en el equilibrio es 1,1
b) El número de moles de hidrógeno en el equilibrio es 0,1
c) Kc vale152
d) Kp vale 5
DATOS: R=0,082 atm.L K-1.mol-1
52.Escribe Lavoisier en el Tratado
elemental de química de 1789, que el óxido de mercurio rojo es uno de los
compuestos más apropiados para producir oxígeno, ya que en este óxido el mercurio
tiene muy poca afinidad por él, y se separa al grado de temperatura en que
comienza a ponerse el vidrio al rojo. En esta reacción, a 200ºC, el óxido
de mercurio II, sólido produce mercurio gas y oxígeno. Si
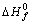 del HgO y Hg son en kJ/mol, 90,7 y 60,8, respectivamente y las
del HgO y Hg son en kJ/mol, 90,7 y 60,8, respectivamente y las
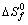 en J/K.mol, son respectivamente 72,
y 174,9 y para el oxígeno, 205J/K.mol)
dirás que la constante de equilibrio en estas condiciones será:
en J/K.mol, son respectivamente 72,
y 174,9 y para el oxígeno, 205J/K.mol)
dirás que la constante de equilibrio en estas condiciones será:
a) 1,1.10-14 b)1,1,1014 c)1.1015 d) 1.10-15
DATO:R=8,31 J.K-1.mol-1
53*.Priestley uno de los pocos
ingleses simpatizantes de la revolución francesa, origen de su forzada emigración
a Pensilvania, fue el bautizador del caucho en inglés: rubber, porque tenía
la propiedad de borrar las manchas de lápiz, y también fue el que obtuvo por
primera vez el gas de agua, haciendo reaccionar carbón al rojo con agua. Una
de las reacciones características del gas de agua es CO+H2O=CO2+H2,
todos ellos gases. Si Kp a 690K vale 10 y a 800K, es 3,6 podrás decir de esta
reacción que:
a) Es exotérmica
b) La energía de activación para la reacción directa es mayor que para
la inversa
c) Es exergónica
d) La variación de entalpía en la reacción es -42,6 kJ/mol
DATO:R=8,31 J.K-1.mol-1
54.En 1933, Lewis aunque no descubre
el agua pesada, aporta la primera muestra del compuesto puro. Diez años después,
este compuesto tendría una importancia mundial estratégica, en la moderación
de neutrones de un incipiente reactor nuclear. Al igual que el agua normal,
reacciona con el acetileno, intercambiando deuterio, y formando acetileno
pesado C2D2.La entalpía de reacción en este proceso
vale 2,22 kJ/mol. Si a 25EC, Kp=0,820,
cuando un mol de etino reacciona con 3 de agua pesada, los moles de acetileno pesado que se formarán a 100EC, serán:
a) 0,25 b)0,50 c) 0,75 d)
0,1
DATO:R=8,31 J.K-1.mol-1
55*.La molécula de dióxido de
nitrógeno se dimeriza. Determina el calor de reacción para este proceso, sabiendo
que Kp a 298K es 8,85 y a 373; 0,0792. Podrás asegurar que:
a) La reacción es exotérmica
b) Si calientas la reacción se desplaza hacia la izquierda
c) La constante de la reacción
inversa a 298K es 0,11
d) Si en condiciones normales el
grado de disociación en la reacción inversa es del 25%, la presión a que estaba
sometido el sistema en el equilibrio es de 0,42 atm.
DATO:R=8,31 J.K-1.mol-1
56*.La mayoría de los libros de
textos emplean la síntesis o descomposición del IH, como reacción modélica
para estudiar la cinética y el equilibrio químico, debido al completo trabajo
realizado por Boldestein en 1894. Para su proceso de descomposición Kp a 764K,
vale 0,021, y a 667K, 0,0164. Si ambos procesos se desarrollaron a presión
constante de 1 atm, dirás que:
a) La reacción es endotérmica
b) El grado de disociación a 764 K es del 98%
c) El grado de disociación aumenta al aumentar la temperatura
d) La presión parcial en el equilibrio del yoduro de hidrógeno disminuye
al aumentar la temperatura
DATO:R=8,31 J.K-1.mol-1
58*. Los valores de la variación
de entalpía y energía libre de Gibbs,
para el yoduro de hidrógeno, yodo gas e hidrógeno gas a 25EC, son respectivamente
( 26,5; 62,4 y 0kJ/mol) y (1,7; 19,3 y 0 ) kJ/mol. Según eso dirás que, si
estos valores permaneces constantes, en la disociación en fase gaseosa del
yoduro de hidrógeno en yodo e hidrógeno:
a) La variación de entropía en el proceso es de 20 J/K.mol
b) Kp a 25ºC es 0,0016
c) El grado de disociación del yoduro de hidrógeno a 25ºC es 7,5%
d) Kc a 200ºC es 0,0066
e) El grado de disociación aumenta en un 50% al aumentar la temperatura
hasta 200ºC
DATO:R=8,31 J.K-1.mol-1
59*.A principios del siglo XX
la mayoría de los explosivos se confeccionaban a base de nitratos, y la fuente
natural de ellos era el nitro de chile. Durante la primera guerra mundial,
la armada británica bloqueó la importación de nitratos por parte de Alemania,
y muy mal lo hubiera pasado sino hubiera mejorado Haber, la síntesis del amoniaco
a partir del cual se producía un nitrato barato. Así consiguió el Nobel en
1918.Conociendo Kp a 350EC y 450EC, 0,026 y 0,00659 para dicha síntesis podrás
asegurar que dicha obtención mejorará su rendimiento si
a) Se calienta la reacción
b) Se enfría la cámara de obtención
c) Aumenta la presión sobre el sistema
d) Se extrae continuamente amoniaco
DATO:R=8,31 J.K-1.mol-1
60. Al ser calentado el hidrógeno
carbonato sódico sólido hasta 110ºC, se descompone en carbonato sódico sólido
y dióxido de carbono y agua. La presión de equilibrio es de 1,25 atmósferas.
Según eso la variación de la energía libre en este proceso, será en J/mol.
a) 3000 b) 2992
c) -2992 d)-3000
DATO:R=8,31 J.K-1.mol-1
![]() b)
b)
![]() c)
c)
![]() d)
d)
![]()
![]() =-218 kJ/mol, dirás que:
=-218 kJ/mol, dirás que: