ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
TEST
DE EQUILIBRIO QUÍMICO I
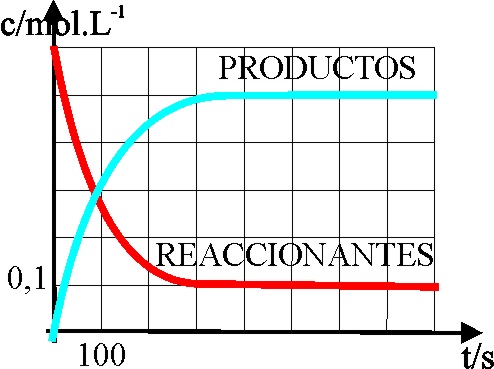
1*.En las reacciones de
primer orden, dado que v = -dc/dt (el signo menos indicará disminución de
la concentración con la velocidad), y v = kc, la función que representa la
variación de la concentración de los reaccionantes y de los productos de reacción
con el tiempo, es una curva, tal como la de la figura. Sin embargo, experimentalmente
se demuestra, que en las reacciones reversibles, al cabo de cierto tiempo,
la concentración se va a mantener constante. Esto quiere decir que:
a)
La velocidad de reacción es cero
b)
La reacción terminó
c)
La velocidad con que se gastan los
reaccionantes es igual a la de su formación
d)
Se ha alcanzado un estado de equilibrio
e)
No se obtiene más rendimiento en la reacción
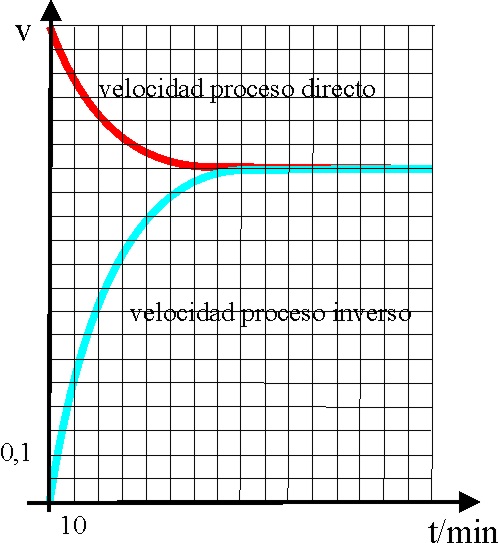
6*.Lemoine en 1877, y después
Bodenstein, estudiaron la reacción entre el yodo y el hidrógeno para formar
yoduro de hidrógeno en fase gaseosa. El estudio gráfico de la variación de
la velocidad con el tiempo para los dos procesos, el directo con formación
de yoduro de hidrógeno y el inverso con la descomposición del mismo, es que
el que se presenta. En dichas gráficas observamos que al cabo de un tiempo
t, la velocidad v1, que corresponde a la formación del producto
(reacción directa), es igual en módulo, a la velocidad v2, con
que se vuelven a formar los reaccionantes gastándose los productos (reacción
inversa). Ello te permitirá asegurar que en dicho proceso:
a) v1 = v2
b) El cociente de las concentraciones
de productos y reaccionantes es una constante K
c) Al cabo de 80 minutos se alcanza el estado de
equilibrio que ya no depende del tiempo
d) La constante K solo depende de P, V y T
7. La constante de equilibrio
según la ley de acción de masas tal como fue definida por Guldberg y Waage,
vendrá expresada en:
a)
moles/litro
b)
moles/litro.segundo
c) atmósferas
d)
es adimensional
e) moles.atmósfera/litro
8*.Inicialmente el equilibrio
se estudió en sistemas líquidos tales como la reacción de esterificación.
Va a ser Van't Hoff, en 1886, el que suponiendo que en un sistema gaseoso
en equilibrio los componentes se comportan como gases ideales, determine una
constante de equilibrio en función de las presiones parciales que ejercerían
los gases producto de la reacción y los reaccionantes. Dicha constante Kp,
está relacionada con Kc a través de:
a)
La ecuación de los gases ideales
b)
El incremento de moles entre los productos y los reaccionantes
c)
La temperatura del sistema en equilibrio y el incremento de moles entre productos
y reaccionantes
d)
La presión que se ejerce en el equilibrio
9.El prefijo et que en
la nomenclatura orgánica se le asigna a todos los compuestos que tienen 2
carbonos, proviene de lo que ahora conocemos como éter, antes aceite dulce
de vitriolo, descubierto ya en 1540, por Valerio
Cordus, dada su inflamabilidad y facilidad para arder (aither es arder
en griego). Aither, generó éter y de ahí etílico, alcohol con dos carbonos,
que generalizó el et para compuestos orgánicos dos carbonos. Si mezclamos
1 mol de etílico, con otro de etanoico, repitiendo la tan estudiada reacción
prototipo de esterificación, de Williamson, Berthelot y Gilles y la mezcla
en equilibrio contiene 2/3 de mol de éster y otro tanto de agua, podrás afirmar
que la constante de equilibrio a esa temperatura será:
a) 1/4 b) 2/3 c)1 d) 4

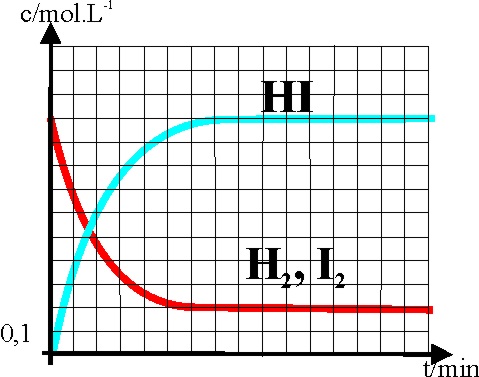
10. El gráfico dado refleja
la variación de las concentraciones de los integrantes en la síntesis del
yoduro de hidrógeno en fase gaseosa. Si para obtenerlo hemos introducido 1
mol de yodo y otro de hidrógeno en un balón de 1 litro y hemos calentado hasta
100ºC, dirás si observas con cuidado la gráfica que Kc vale:
a)
40 b) 64 c) 0,025 d) 25
2. En 1801, en “Investigaciones
sobre las leyes de la afinidad”, el francés Berthollet, explica el efecto
masa, a través del cual, al aumentar la concentración se producía una reacción
mas completa, pero hasta un punto en el que los productos finales producen
los iniciales alcanzándose un estado de equilibrio. Esta es la primera referencia
a la ley que rige actualmente los procesos reversibles. Este estado
de equilibrio se caracterizará por:
a)
El aumento continuado de la concentración de los productos
b)
La disminución permanente de la concentración de los reaccionantes
c)
La igualdad en las concentraciones de los reaccionantes y de los productos
d)
La constancia de las concentraciones al cabo de determinado tiempo
3. 60 años mas tarde de
la publicación de los trabajos de Berthollet, otro francés de apellido parecido
Berthelot, junto con Saint Gilles, estudia el proceso de esterificación, en
el cual alcohol+ ácido produce éster
+ agua, indicando que “la cantidad de éster formado es proporcional al producto
de las sustancias reaccionantes e inversamente proporcional al volumen”. Sin
embargo al no considerar la reacción inversa, no pudieron materializar la:
a)
Ley del equilibrio químico
b)
Ley de conservación de la masa
c)
Ley de la constancia de las concentraciones
d)
Ley de los volúmenes constantes
4. Ya en 1850, Williamson,
había observado que en la reacción de esterificación del ácido acético con
etanol, se alcanzaba un estado tal, que al modificar la concentración de alguno
de los integrantes en la misma, ella misma modificaba los demás, concibiendo
que se había alcanzado un estado de equilibrio dinámico. 14 años después,
dos profesores de química de la universidad de Cristianía (actualmente Oslo),
Cato Guldberg, de Matemáticas y Peter Waage de Química, cuñados, establecieron
que las velocidades de la reacción
directa e inversa eran proporcionales a las masas activas, y de su igualdad,
dedujeron una ley que se denominó, de:
a)
las proporciones definidas
b)
acción de masas
c)
las proporciones múltiples
d)
constancia de las velocidades
5*. El 11 de marzo de 1864, los profesores Guldberg y Wage,
de matemáticas y química respectivamente, de la universidad de Cristianía
(actualmente Oslo), publicaron un trabajo con el título de “Ley de acción
de masas”, que pasó desapercibido hasta que en 1867 se tradujo al francés.
Suponían una reacción de doble desplazamiento A+ B = A’ +B’ (lo aplicaron
al sulfato bárico con carbonato potásico), siendo sus concentraciones respectivas
(que llamaron masas activas) p, q, p’ y q’, de ese modo las “fuerzas de afinidad”
entre A y B eran iguales a kpq, siendo k un llamado coeficiente de afinidad,
mientras que las fuerzas opuestas que causaban la regeneración de A y B, lo
eran a k’p’q’, en consecuencia llegaba
un punto en el que ambas fuerzas eran iguales, produciéndose un equilibrio
en el cual la relación entre las masas activas (actualmente concentraciones
o actividades) intervinientes:
a)
Era un cociente de coeficientes
b)
Tendía a cero
c)
Era constante
d)
Tendía a la unidad
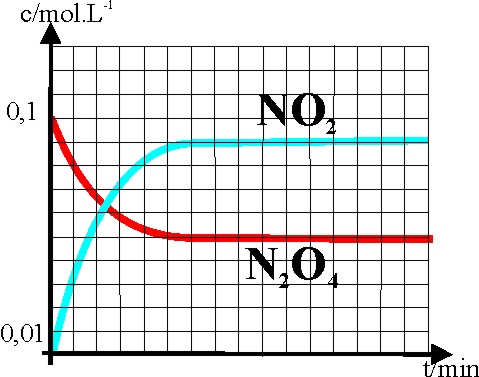
13.Antiguamente la mezcla
del tetraóxido de dinitrógeno, y el dióxido en equilibrio fue llamada por
el inglés Graham que la estudió, peróxido de nitrógeno, creyendo que se trataba
de un único compuesto. El gráfico dado refleja la variación de las concentraciones
de los integrantes en la descomposición del tetraóxido de dinitrógeno en el dióxido
correspondiente en fase gaseosa. Si
para obtenerlo hemos introducido 0,1 moles de tetraóxido en un balón de 10
litros y hemos calentado hasta 350K, dirás si observas con cuidado la gráfica
que Kp vale aproximadamente:
a)
4,6 b) 6,4 c)0,025 d) 2
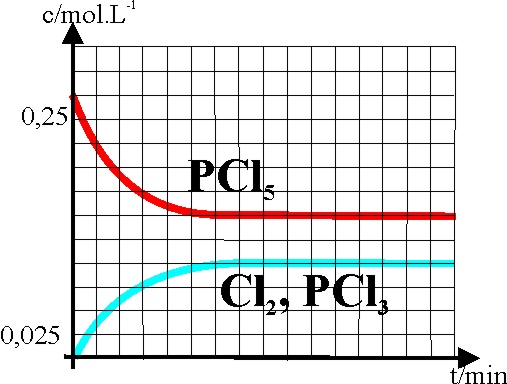
14.El pentacloruro de fósforo
fue descubierto por el inglés Davy en 1810, pero su disociación por encima
de los 300ºC, solo fue conocida por
Wurtz, 60 años después. El gráfico dado refleja la variación de las concentraciones
de los integrantes en la descomposición del pentacloruro de fósforo en tricloruro
y cloro en fase gaseosa. Si para obtenerlo hemos introducido 2,5 moles de
pentacloruro en un balón de 10 litro
y hemos calentado hasta 543K, dirás si observas con cuidado la gráfica que
el grado de disociación
![]() vale:
vale:
a)
0,4 b) 0,6 c)0,8
mientras que Kp vale aproximadamente
a)
4 b) 3 c)0,5
15*.En
un proceso en equilibrio A(g)+ B(g) X2C(g),
a 500K, en un recipiente de 10L, los moles
iniciales de A y B fueron respectivamente 3 y 1 moles y en el equilibrio
se encontró que el número de moles de C es la mitad que de B. Por todo ello
podrás asegurar que
a) La concentración en el equilibrio de A es 0,28 mol.L-1
b) La concentración en el equilibrio de C es de 0,2mol.L-1
c) Kc vale 0,071
d) Kp vale 0,036
DATOS: R=0,082
atm.L K-1 mol-1
16*.En
el proceso en equilibrio A(g)+ 2B(g) XC(g),
a 500K, en un recipiente de 10L, los moles
iniciales de A y B fueron respectivamente 2 y 1 moles y en el equilibrio
se encontró que el número de moles de C es
el doble que de B. Por todo ello podrás asegurar que
a) La concentración en el equilibrio de A es 0,16 mol.L-1
b) La concentración en el equilibrio de B es de 0,2mol.L-1
c) Kc vale 625
d) Kp vale 0,036
DATOS: R=0,082
atm.L K-1 mol-1
17*. En el equilibrio en
estado gaseoso A+B= 2AB, teniendo en cuenta que los coeficientes estequiométricos
coinciden con los cinéticos, si introduces un mol de A, otro de B, en un recipiente
de 1 litro, calentando hasta la temperatura necesaria para que Kc sea 45,9,
podrás afirmar que:
a)
La reacción directa es de primer orden
b)
La reacción indirecta es de segundo orden
c) Kp deberá ser igual a Kc
d) La concentración final de AB será de 1,54 moles/litro
e)
La concentración final de B, será de 0,23 moles/litro
18*.
En una vasija de 10 litros se introducen 5 moles de tetraóxido de dinitrógeno (g) y se cierra herméticamente.
Se calienta hasta 700K, aumentando la presión debido a la disociación térmica,
en dióxido de nitrógeno, hasta alcanzar en el equilibrio 30 atm. Según eso
podrás asegurar que:
a) El grado de disociación del tetraóxido de dinitrógeno
es del 45%
b) La presión parcial del dióxido de nitrógeno en el
equilibrio es 2,58 atm
c) Kp vale 0,247
d) Si se duplica la presión, el grado de disociación
valdría 0,32%
19*. Una mezcla
gaseosa que está constituida inicialmente por 4 moles de yodo y 1 de hidrógeno,
se calienta hasta 700K, alcanzando el equilibrio cuando se han formado 1,95 moles de yoduro de hidrógeno. Por
todo ello podrás afirmar que:
a)
Kc = Kp = 53,4
b)
Si se partiera de 4 moles de hidrógeno
y uno de yodo, la composición final sería la misma
c)
El en caso anterior se obtendría prácticamente la misma cantidad de yoduro
de hidrógeno
d)
Prácticamente se invertirían las composiciones finales de yodo e hidrógeno
al invertirse las iniciales
20*. Una de las reacciones
estudiadas desde hace mas tiempo es la llamada “reacción del gas de agua”:
CO2(g) + H2(g)
![]() CO(g) + H2O(g), en la cual se obtiene
una mezcla en equilibrio de hidrógeno, óxidos de carbono en un ambiente húmedo.
Si al mezclar inicialmente 49,3 moles de CO2 y 50,7 moles de H2
a 1000K, se encuentra una composición en el equilibrio de 21,4 moles de CO2,
22,8 moles de H2, 27,9 moles de CO y 27,9 moles de H2O,
sin embargo si se partiera de 60 moles de CO2
y 40 de H2, podrás asegurar que la mezcla obtenida:
CO(g) + H2O(g), en la cual se obtiene
una mezcla en equilibrio de hidrógeno, óxidos de carbono en un ambiente húmedo.
Si al mezclar inicialmente 49,3 moles de CO2 y 50,7 moles de H2
a 1000K, se encuentra una composición en el equilibrio de 21,4 moles de CO2,
22,8 moles de H2, 27,9 moles de CO y 27,9 moles de H2O,
sin embargo si se partiera de 60 moles de CO2
y 40 de H2, podrás asegurar que la mezcla obtenida:
a)Tiene
menos cantidad de monóxido de carbono
b)
Tiene más cantidad de vapor de agua
c)
Tiene la misma Kc
d)
Deja un % de hidrógeno del 17,7%
11. Si en un proceso A+ B = C+D, te dicen que la constante de equilibrio
Kc, es 1, puedes interpretarlo como que:
a)
La cantidad de producto obtenida al final
es igual a la inicial
b)
Hay igual número de moles al final que
al principio
c)
El producto de la concentración de A y
B, es igual al C y D
d)
El rendimiento de la reacción es del 50%
12. Kc será igual a Kp:
a)
En todos los equilibrios en disolución
b)
Cuando valga 1
c)
Siempre que el número de moles de los productos sea igual al de los reaccionantes
d)
a 0º
13*. Muchas veces habrás
observado que Kp es menor que Kc, esto solo ocurre si:
a)
Los moles de los productos son más que los moles de los reaccionantes
b)
Los moles de los productos son menos que los moles de los reaccionantes
c)
La temperatura absoluta es muy baja y el número de moles de los productos
es mayor que el de los reaccionantes
d)
La temperatura absoluta es muy baja y el número de moles de los productos
es menor que el de los reaccionantes