ENSEÑANZA DE LA FÍSICA Y LA QUÍMICA
TEST
DE QUÍMICA CON ENUNCIADOS FORMATIVOS
Átomo
2. Átomo cuántico
20.
Luis de Broglie leyó en la Sorbona
(París), su tesis doctoral revolucionaria sobre la teoría corpúsculo ondulatoria,
el 25 de noviembre de 1924, y el presidente de su tribunal, Jean Perrin, también
había sido un físico revolucionario en su día, al proponer su modelo atómico
planetario, todavía antes que Thomson, diera a conocer el suyo. Sin embargo
nadie le hizo caso, lo que no le ocurrirá a De Broglie, cuya teoría:
a)
Explicará el comportamiento de los cuantos de luz
b)
Servirá de base a la teoría ondulatoria del electrón
c)
Justificará un nuevo modelo atómico
d)
Se empleará necesariamente a cualquier tipo de partícula
en movimiento
INDIQUE LO QUE
NO SEA.
21. Luis de
Broglie, destinado por su noble familia, a ser político (estudió Historia
en La Sorbonne de París). Le tomó gustillo a la Física, cuando su hermano,
lo llevó en 1911, al primer congreso Solvay, del que era secretario. Allí
se reunió la flor y nata de la ciencia europea; estaba
Einstein, Curie, Lorentz, Planck, Sommerfeld y Rutherford, entre otros. Precisamente
Einstein había terminado de aclarar la naturaleza corpuscular de la luz, al
explicar el efecto fotoeléctrico. Trece años mas tarde, al justificar la naturaleza
corpúsculo-ondulatoria de la luz, complementará el trabajo de Einstein. Según
De Broglie, la longitud de onda asociada a una partícula en movimiento era:
a) Inversamente proporcional a su velocidad
b) Directamente proporcional a su masa
c) Dependía de la constante de Planck
d) Era inversamente proporcional a su
masa
INDIQUE LO QUE NO SEA
22. Existe
gran discrepancia en qué es lo que fue antes: Mecánica cuántica o Mecánica
ondulatoria. Realmente este último término ya aparece en los trabajos previos
a la tesis de De Broglie, de 1924, antes de su desarrollo en 1926. De Broglie,
Nobel de Física de 1929, nada menos que apoyado por doce famosos científicos
(hecho verdaderamente inusual), tuvo el acierto de reforzar a partir del concepto
dual, las propias teorías de Bohr y Sommerfeld, dado que:
a) En un estado estacionario debería
haber un número entero de longitudes de onda
b) Llega a través de las ondas a la
cuatización del momento angular
c) Explica la naturaleza elíptica de
las órbitas electrónicas
d) Justifica el número cuántico de
Bohr
INDIQUE LO QUE NO SEA
23.
Uno de los problemas que mantuvieron dura pugna entre los científicos
durante 3 siglos fue la explicación de la naturaleza de la luz. Mientras unos
la suponían corpuscular, otros reafirmaban su característica ondulatoria,
y todos aportaban pruebas y experimentos que apoyaban sus ideas. Esta rivalidad
se mantuvo hasta que surgieron a finales de 1923 en la revista Comptes Rendus,
y al año siguiente en la Philophical Magazine (la revista científica más prestigiosa
del momento), unos artículos científicos de Luis de Broglie en los que aunaba
ambos compor-tamientos, que se podrían resumir en que la longitud de onda
8 asociada a la partícula en movimiento (onda de fase)
= h/mv, pero sólo era apreciable a medidas atómicas. Según eso, si se aplicase
a un balón de fútbol de 800g. que sale de la bota
del encargado de lanzar un penalty a 102 km/h, siendo h=6,62.10-34
J.s. la longitud de onda asociada sería :
a) 8,11.10-39m b) 8,11.10-36m c) 2,25.10-36m d) 2,25.10-39m
24. En el artículo: "Ensayo sobre una teoría
sobre los cuantos de luz", publicado por Luis de Broglie, en la Philosophical Magazine,
en 1924 se puede leer: "Estamos
inclinados a creer que cualquier cuerpo en movimiento debe venir acompañado
de una onda y que es imposible separar el movimiento del cuerpo, del de propagación
de la onda". La onda así mencionada del electrón del hidrógeno que se
mueve con una velocidad v, excitado al nivel 3, deberá tener una longitud de De Broglie lDB:
a) 3h b)
3mv
c) 3h/mv d) 2mv/3
25. Thomson, llamado por muchos J.J.(iniciales de su nombre), recibió en 1908 el Nobel de Física, por el descubrimiento del electrón como partícula de los rayos catódicos y su hijo George, lo consiguió 29 años después por sus experimentos para comprobar el comportamiento de aquél como onda que se basaba en un fenómeno de:
a) Reflexión
b) Refracción
c) Difracción d) Polarización
26. Pauli
y Heisenberg fueron alumnos de Sommerfeld en Munich y después ayudantes de
Born en Gotinga, y más tarde colaboradores de Bohr en su institución de Copenhague,
y ambos Nobel en 1932 y 1945 respectivamente. Del segundo, conocerá que enunció su:
a) Principio de Exclusión b) Principio de Incertidumbre
c) Teoría Corpúsculo-ondulatoria d) Teoría
orbital del electrón e) Nada de lo dicho.
27. Pese a que aplicó la teoría cuántica
de Planck para resolver y aclarar el efecto fotoeléctrico, que le valdría
el Nóbel de Física de 1922, no creía en ella. Por eso acuñó la famosa frase:
“Dios no juega a los dados”. Efectivamente Einstein no creía en la teoría
de las probabilidades aplicada al átomo y al final de su vida le escribía a su amigo Besso que, “aún no tenía
una idea clara de lo que eran los cuantos… hoy en día todo el mundo cree que
lo sabe pero se equivoca”. Sin embargo Einstein iba en contra de la tendencia
científica del momento, encabezada por Heisenberg, que al enunciar su principio
de incertidumbre, no sólo abrió una nueva perspectiva a las teorías atómicas,
sino que emitió un principio filosófico, ya que:
a) Al precisar una medida, la podemos alterar incurriendo
en un error mayor
b)
No se podía determinar con precisión y simultáneamente la posición
y la velocidad de un electrón
c)
La incertidumbre provocada en una medida
tenía como límite la velocidad de la luz
d)
No se podía determinar simultáneamente con precisión la energía y el
tiempo de recorrido de un electrón.
INDIQUE LO QUE NO SEA
28. Heisenberg,
hijo de un catedrático de filología medieval de la universidad de Munich,
era una especie de niño prodigio de salud quebradiza, que siendo adolescente
se había leído y estudiado, en una convalecencia, uno de los libros mas importantes
sobre la teoría de la relatividad: “Espacio-tiempo y materia” del matemático
Weyl, que lo motivó para estudiar la física. Por eso con 18 años, pasó a ser alumno de Sommerfeld,
quien le dijo que si algo no entendía de sus explicaciones se lo preguntara
a Pauli, que había comenzado un año antes.. Aunque
su teoría atómica de matrices, no tuvo mucho éxito, sí lo consiguió con su
Principio de Incertidumbre, resumido en la expresión )p.)x = h/2p, siendo las los incrementos dados, las incertidumbres
en la cantidad de movimiento y posición. Si se aplicaba al átomo de hidrógeno
cuyo radio experimental era de 0, 53 D, y siendo la masa del electrón (9,1.10-31
kg) y la constante de Planck, h=6,6.10-34J.s se podrá asegurar que la velocidad prevista
para el electrón en su órbita debería ser en m/s, aproximadamente de:
a) 1,4.107 b)1,4.106 c) 1,4.109 d)1,4 e) NADA DE LO DICHO
29* Schrödinger,
13 y 14 años mayor que Heisenberg y Pauli, estudió en Viena, y aunque su nombre
se le asocie a las teorías atómicas modernas, por introducir la función de
onda y, en la onda de fase de De Broglie, y en unos coloquios
dirigidos por Debye en la Escuela Politécnica de Zurich, en enero de 1926,
al explicar la teoría de las ondas de De Broglie que aquél creía cosa de niños,
dijo: “Mi colega Debye sugirió que se debía encontrar una ecuación de ondas,
pues bien, he encontrado una”. Así surgió la famosa “ecuación de Schrödinger”,
en la cual la función de onda y:
a) Representaba la probabilidad de
encontrar un electrón
b) Significaba la densidad de probabilidad
c) Solo era un artificio matemático
sin significado físico
d) Era la amplitud de la onda de De
Broglie
INDIQUE LO QUE NO SEA
30. Aunque se atribuye a Max Born, en 1926, la interpretación probabilística de la función de onda, base física a toda la mecánica ondulatoria del electrón, sin embargo sólo recibió el Nobel por ello en 1954, a los 72 años de edad, mucho más tarde que la mayoría de sus discípulos y ayudantes, que con las ideas de su maestro construyeron la teoría orbital, debido a la oposición de Planck, Schrödinger y del mismo De Broglie. A partir de sus ideas se considerará que un orbital atómico es:
a)
El camino seguido por los
electrones
b)
La zona más probable donde
se podía encontrar a los electrones
c)
La zona en la que hay el
90% de probabilidad de encontrar a los electrones
d)
El espacio que rodea a
los núcleos de los átomos
31. El primer artículo de Schrödinger apareció
en 1926, en la revista alemana Annalen der Physik, tal como los primeros trabajos
de Einstein, por cuyos manuscritos se llegaron a pagar hasta 6 millones de
dólares (esto en 1944).En él, tomaba las ideas de De Broglie y las aplicaba
a las ondas, obteniendo una ecuación matemática que cambiaría el mundo de
la física del átomo. Esta ecuación permitió:
a) Definir
los orbitales atómicos b) Encontrar los números
cuánticos
c)
Determinar a los electrones en los átomos d) Explicar los espectros atómicos
32.
La incertidumbre del electrón en el átomo, fue expresada por Schrödinger
con su célebre paradoja (denostada por la Sociedad Protectora de Animales),
llamada "El gato de Schrödinger".En una caja cerrada ponía una fuente
de material radiactivo, un contador de radiación
que al ponerse en funcionamiento abría un recipiente con cianuro, y
un gato vivo. Al cabo de un cierto tiempo, podrías decir que el gato estaba:
a) Muerto
por la acción del cianuro
b) Vivo porque jugando estropearía
el contador radiactivo
c)
Muerto debido a las radiaciones
d) No se podría asegurar nada
33* Max Born
acuñó el término de Mecánica cuántica, en un seminario celebrado en Gotinga
en junio de 1924, y se puede decir que fue su precursor, pero en principio
se opuso a las teorías de Schrödinger y Pauli, apoyadas por Sommerfeld. Posteriormente, a partir de 1926, sería su máximo impulsor al considerar
que el cuadrado del módulo de la función y, debería representar la densidad de probabilidad de
los electrones u otras partículas, aclarando y dando sentido físico a las
soluciones de la ecuación de Schrödinger. Ahora bien, esta interpretación
no es del todo original suya, pues mucho tiempo antes Einstein, había intentado
explicar la dualidad de los cuantos de luz, considerando el cuadrado de la
amplitud óptica de la onda como la densidad de probabilidad de la existencia
de los fotones. La diferencia entre Y y y2 estriba en que:
a) Y tiene significado físico y
y2 , no
b)
Y no tiene significado
físico y y2
, si lo tiene
c)
Y toma valores negativos y y2 , siempre será positivo
d)
Y está asociado
a la probabilidad y y2
, no
INDIQUE
LO QUE SEA CORRECTO
34.
Aunque no te lo creas la segunda guerra mundial se terminó gracias
a Niels Bohr, pues Japón firmó su rendición en 1945, a causa del espanto e
impacto causado por las explosiones atómicas en Hirosima y Nagasaki, y éstas
se consiguieron, porque Bohr, cuando escapó de Dinamarca, llevó a Estados
Unidos toda la documentación proporcionada por Lise Meitner, sobre la fisión
nuclear realizada por Hahn, Strasmann y ella misma, en Berlín. Este
hecho fue quizá uno de los que más amargaron su vida. Sin embargo su primer
éxito fue el determinar teóricamente el radio del hidrógeno a través de su
teoría, y comprobar que coincidía con el experimental, de 0,53 D , aun en la teoría atómica actual. Sin embargo el orbital
atómico asignado al electrón 1s del hidrógeno difiere de la primitiva órbita
ya que:
a) El orbital 1s tiene un contorno esférico
b) El tamaño del orbital es mucho mayor
que el de la órbita
c) Sólo la zona más probable dentro
del orbital 1s corresponde a la órbita 1s
d) El orbital es más pequeño que la
órbita
INDIQUE LAS
SOLUCIONES NO VÁLIDAS
35 La forma
de los orbitales atómicos depende de los valores que tome l en la resolución
de la ecuación de Schrödinger, porque su número indica el de planos nodales
que delimitan las zonas de mayor o menor probabilidad. Pero dentro de estas
zonas existen otras que corresponden a valores de Y= 0, denominadas superficies nodales, este número es
igual a n-(l+1), por este motivo un OA 3d, denerá tener
:
a) 2planos nodales y 1 superficie nodal
b) 1 plano nodal y 1 superficie nodal
c) 2 planos nodales y ninguna superficie
nodal
d) 1 plano nodal y ninguna superficie
nodal
e) Nada de lo dicho
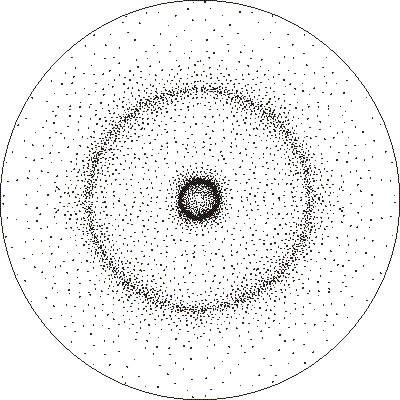
36*. Uno de los
modelos mas intuitivos para representar un orbital atómico fue el de
nube de carga, en él se representa la situación instantánea de electrón de
un átomo como un punto material. De esa forma las zonas mas oscuras representarían
aquellas con mayor densidad de carga, y por lo tanto las más probables. En
el dibujo se presenta un modelo de nube de carga del orbital atómico 3s, en
el plano. De ese dibujo se pueden sacar las conclusiones que en ese orbital
hay:
a) Dos zonas con mayor probabilidad
b) La probabilidad es similar en todo
el contorno del orbital
c) La densidad de carga es mayor en la
proximidad del núcleo
d) No tiene ningún plano nodal ni superficie
nodal
37*.
Mulliken muy conocido por su teoría de orbitales moleculares
y sus medidas de la electronegatividad, fue el que bautizó en 1928 a las funciones
de ondas salidas de la ecuación de Schrödinger como orbitales atómicos. Si
conoce el 2s y el 2p podrá asegurar
que se diferencian en:
a) el número de superficies nodales
b) en el tamaño
c) en la forma
d) en el número de planos nodales
a)
Un plano nodal y una superficie nodal
b) Un plano nodal y ninguna superficie nodal
c)
Sólo una superficie nodal
d)
Sólo un plano nodal

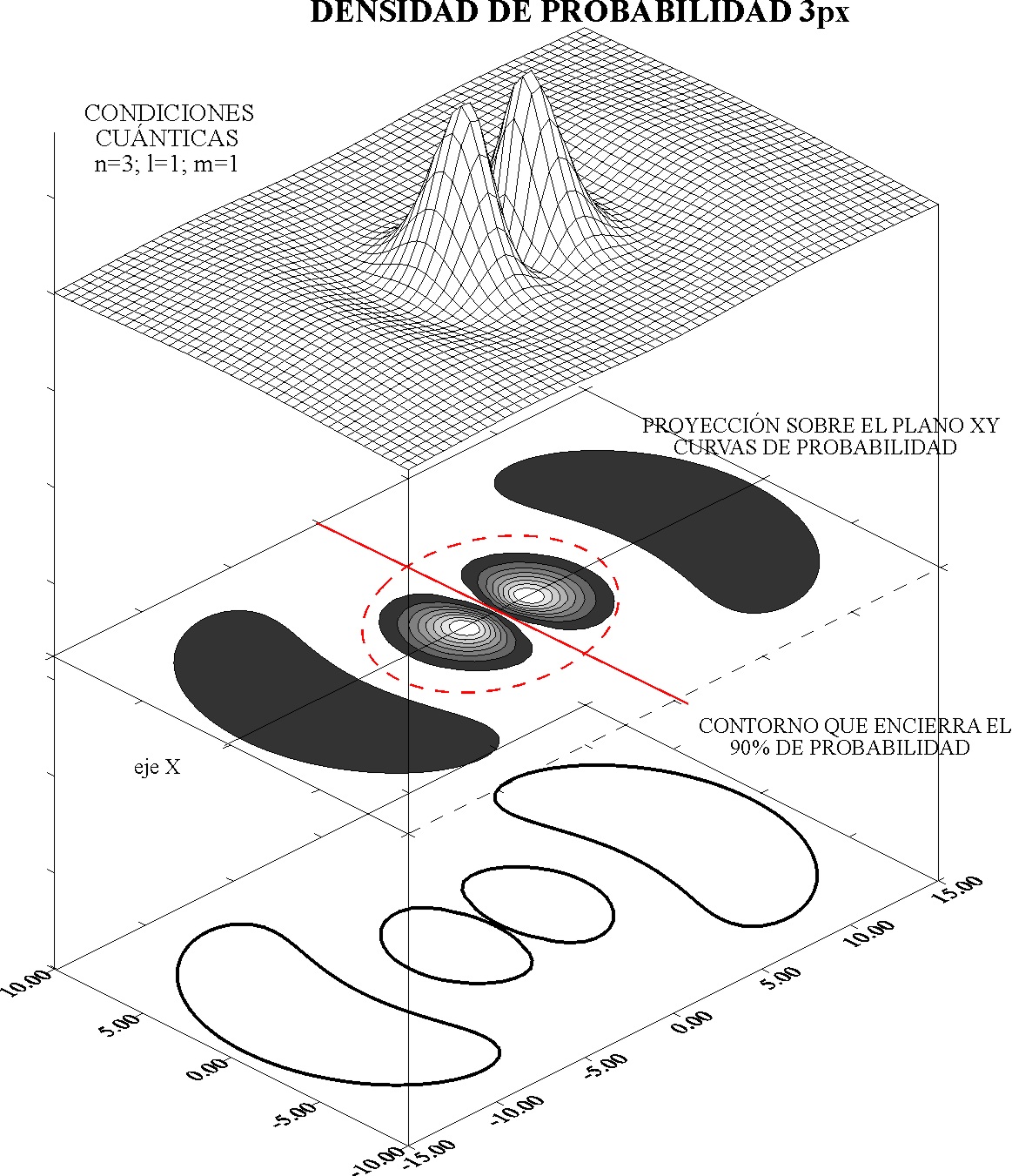
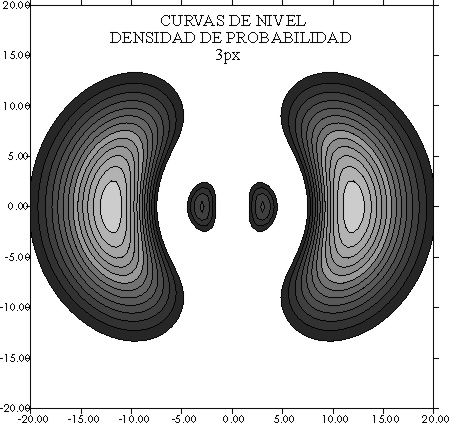
38.
El nombre de plano nodal, o zona nodal, procede de los puntos en los
que las ondas estacionarias poseen amplitud nula (nodos), dado que las ondas
del electrón como las de las cuerdas o membranas fijas entre puntos, deben
cumplir esas condiciones. En las curvas de densidad de probabi-lidad que
se presentan , se podrá asegurar que hay:
a) Un plano nodal y una superficie nodal
b) Dos
planos nodales y una superficie nodal
c) Dos planos nodales y ninguna superficie nodal
d) Un
plano nodal y ninguna superficie nodal
e) Nada de lo dicho